
بطاقة الدرس:
- عنوانه: المحاليل الحمضية والمحاليل القاعدية.
- ترتيبه: الثاني من الفصل الثاني «المخاليط والمحاليل»، الوحدة الأولى «دراسة المادة».
- مادة: العلوم.
- الصف: الثاني المتوسط.
- الفصل الدراسي: الأول.
- المدارس/المناهج: السعودية.
- الهدف: تلخيص/مراجعة وحل أسئلة.
- الدرس السابق: المحاليل والذائبية
أولاً: المحاليل الحمضية
تعريف الأحماض: هي مواد تطلق أيونات الهيدروجين الموجبة (H+) عند ذوبانها في الماء.
خصائص المحاليل الحمضية:
- طعمها حامض ولاذع.
- كاوية وحارقة لأنسجة الجسم.
- محاليلها موصلة للكهرباء.
- تتفاعل بقوة مع الفلزات.
استخدامات الأحماض:
- في الطعام: مثل: حمض الخل
- وسيلة دفاع أو اصطياد: مثل: حمض النمل
- في صناعة الأسمدة والطلاء والبلاستيك والبطاريات مثل: حمض الكبريتيك.
- في تنظيف سطوح الفلزات من الشوائب: مثل: حمض الهيدروكلوريك.
- تكوين الكهوف وتشكيل الصواعد والهوابط: مثل: حمض الكربونيك.
أمثلة على الأحماض:
أحماض قوية:
- حمض الهيدروكلوريك: HCL.
- حمض الكبريتيك: H2SO4.
- حمض النيتريك: HNO3.
أحماض ضعيفة:
- حمض الخل: CH3COOH.
- حمض الكربونيك: H2CO3.
- حمض الأسكوربيك: H2C6H6O6.
تعريف أيون اليهيدرونيوم: هو أيون ناتج عن ارتباط أيون الهيدروجين مع الماء وله شحنة موجبة وصيغته (+H3O).
ثانياً: المحاليل القاعدية
تعريف القواعد: هي مواد تطلق أيون الهيدروكسيد (–OH) عند ذوبانها في الماء. أو (مواد تتقبل وتستقبل أيون الهيدروجين عند ذوبانها في الماء)
خصائص المحاليل القاعدية:
- طعمها مر.
- كاوية وحارقة لأنسجة الجسم.
- محاليلها موصلة للكهرباء.
- تفاعلها مع الفلزات أقل من الاحماض.
- ملمسها زلق مثل ملمس الصابون
استخدامات القواعد:
- في معظم مستحضرات التنظيف.
- في تخطيط الملاعب الرياضية، مثل: هيدروكسيد الكالسيوم.
- المنظفات والصابون وتسليك المجاري والمصارف، مثل: هيدروكسيد الصوديوم.
أمثلة على القواعد:
قواعد قوية:
- هيدروكسيد الصوديوم: NaOH
- هيدروكسيد البوتاسيوم: KOH.
قواعد ضعيفة:
- الأمونيا: NH3.
- هيدروكسيد الألومنيوم: AL(OH)3.
- هيدروكسيد الحديد: Fe(OH)3.
الرقم الهيدروجيني (PH)
تعريفه: هو مقياس الحمضية أو قاعدية المحلول وتتدرج قيمته من (صفر – 14) بحيث تكون المحاليل الأقل من (7) محاليل حمضية، والأكثر من (7) محاليل قاعدية، والمحاليل ذات الرقم (7) تكون محاليل متعادلة.
ملاحظات:
- إذا كانت أيونات الهيدرونيوم (+H3O) أكثر من أيونات الهيدروكسيد (–OH) تكون محاليل حمضية.
- إذا كانت أيونات الهيدرونيوم (+H3O) أقل من أيونات الهيدروكسيد (–OH) تكون محاليل قاعدية.
- من الأمثلة على المادة المتعادلة والتي يكون لها الرقم الهيدروجيني يساوي (7) الماء النقي.
حساب الفرق بين قيم (PH):
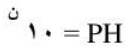
حيث أن: (ن) الفرق بين قيم الرقم الهيدروجيني.
قوة الأحماض والقواعد:
- قوة الحمض تعتمد على سهولة انفصاله إلى أيونات (إطلاق أيونات الهيدروجين) عند ذوبانه في الماء وليس على عدد ذرات الهيدروجين المكونة للحمض.
- قوة القاعدة تعتمد على سهولة انفصالها إلى أيونات (إطلاق أيونات الهيدروكسيد) عند ذوبانه في الماء.
الكواشف
تعريفها: هي مركبات تستخدم للكشف عن المحاليل الحمضية والقاعدية من خلال تغير لونها باختلاف الرقم الهيدروجيني.
مثال: ورق تباع الشمس.
ملاحظة:
- ورقة تباع الشمس الزرقاء تتحول إلى اللون الأحمر عند وضعها في الحمض.
- ورقة تباع الشمس الحمراء تتحول إلى اللون الأزرق عند وضعها في القاعدة.
التعادل
تعريفه: هو تفاعل حمض مع قاعدة ينتج عنه ملح وماء.
المعادلة: حمض + قاعدة ← ملح + ماء.
س: اكمل المقارنة التالية؟
| وجه المقارنة | المحاليل الحمضية | المحاليل القاعدية |
| 1. الأيونات الناتجة | أيونات الهيدروجين | أيونات الهيدروكسيد |
| 2. الطعم | حامض | مر |
| 3. التفاعل مع الفلزات | تتفاعل بشدة | تتفاعل بمعدل أقل من الأحماض |
| 4. تلون ورقة تباع الشمس | تتلون الورقة الزرقاء إلى الأحمر | تتلون الورقة الحمراء إلى الأزرق |
| 5. الرقم الهيدروجيني PH | أقل من 7 | أعلى من 7 |
حل مراجعة الدرس
ج 1:
الأحماض تنتج أيونات الهيدروجين أو الهيدرونيوم.
القواعد تنتج أيونات الهيدروكسيد.
| خواص الأحماض | خواص القواعد |
|
|
ج 3:
- إذا كان تركيز أيونات الهيدرونيوم (+H3O) أكثر من تركيز أيونات الهيدروكسيد (–OH) فإن الرقم الهيدروجيني يكون أقل من (7) أي أنه حمض.
- إذا كان تركيز أيونات الهيدرونيوم (+H3O) أقل من تركيز أيونات الهيدروكسيد (–OH) فإن الرقم الهيدروجيني يكون أكبر من (7) أي أنه قاعدة.
- إذا كان تركيز أيونات الهيدرونيوم (+H3O) يساوي تركيز أيونات الهيدروكسيد (–OH) فإن الرقم الهيدروجيني يكون مساوي لـ (7) أي أنه متعادل.
ج 4: استخدام قاعدة لمعادلة الحمض المنسكب.
خريطة المفاهيم
المادة:
1. النقية: يمكن أن تكون:
- عناصر: تتركب من نوع واحد من الذرات.
- مركبات: تتركب من عنصرين أو أكثر.
2. المخاليط: يمكن أن تكون:
- غير متجانسة: تتركب من عناصر / أو مركبات غير مخلوطة بانتظام.
- متجانسة: تتركب من عناصر / أو مركبات مخلوطة بانتظام.
حل مراجعة الفصل
استخدام المفردات:
- الرقم الهيدروجيني.
- التركيز.
- الذائبية.
- المذاب.
- التعادل.
- المادة النقية.
تثبيت المفاهيم:
- 7: د.
- 8: ج.
- 9: أ.
- 10: ب.
- 11: ج.
- 12: أ.
- 13: ب.
- 14: ج.
- 15: ج.
- 16: د.
التفكير الناقد:
17. الماء يحوي أملاح وعندما يتبخر تترسب الأملاح.
18. بإضافة كمية كبيرة من الماء على كمية قليلة من الحمض القوي.
19. يعمل عمل جسيمات المذاب فيغير من الخصائص الفيزيائية للمذيب وهو الماء.
20. الكريسول الأحمر – الثيمول الأزرق – الكاشف العالمي.
21. يحدث ذلك عندما يعطي أيونات الهيدرونيوم فيعمل كحمض أو يعطي أيونات الهيدروكسيد فيعمل كقاعدة.
22.
| محلول (سائل – صلب) | محلول (سائل – غاز) | محلول (سائل – سائل) |
| يتكون هذا المحلول عندما يكون المذيب سائلاً والمذاب صلبًا مثل: الماء مع الملح. | يتكون هذا المحلول عندما يكون المذيب سائلا والمذاب غاز مثل: المشروبات الغازية. | يتكون هذا المحلول عندما يكون المذيب سائلا والمذاب صلباً، مثل: الخل مع الماء. |
23. متروك للمعلم (اقبل جميع الإجابات المنطقية).
24. يقل معدل الذائبية بارتفاع درجة الحرارة فتقل ذائبية الغاز في السائل فتنطق غازات أكثر من ثاني أكسيد الكربون من علبة الشراب الساخن.
أنشطة تقويم الأداء:
25. متروك للمعلم (يجب تفحص إجابات الطلاب والتأكد منها).
26.
كلوريد الصوديوم = 37 / 100 جرام من الماء.
كلوريد البوتاسيوم = 58جم / 100 جرام من الماء
27.
حجم مسحوق العصير / 1000 مل = 0,18.
حجم مسحوق العصير (مل) = 0,18 × 1000 = 180 مل.
اختبار مقنن الوحدة الأولى
أسئلة الاختيار من متعدد
- 1: د.
- 2: ب.
- 3: ب.
- 4: ج.
- 5: أ.
- 6: ب.
- 7: أ.
- 8: د.
- 9: ج.
أسئلة الإجابات القصيرة
10.
- استنتاج.
- ملاحظة.
- ملاحظة.
- فرضية.
- فرضية
- فرضية.
11. بعد اجراء عدة تجارب من أجل دعمها والتحقق من صحتها.
12. تؤدي إلى استنتاجات خاطئة عند تحليل البيانات.
13.
- الاستنتاج يعتمد على الملاحظة.
- الفرضية تخمين قابل للاختبار.
14. مخلوط غير متجانس: مثل: سلطة الخضار – الزيت والماء – المكسرات.
15. بسبب زيادة مساحة سطح المذاب التي تتعرض لجسيمات السائل مما يزيد من معدل الذوبان.
16. نجد المحلول (ب) أكثر تركيز من المحلول (أ)
ملحوظة: كلا المحلولين ليس محلول مشبع.
أسئلة الإجابات المفتوحة
18.
- لا تسبب التجارب على النبات مشاكل اجتماعية.
- قصر دورة الحياة لكثير من النباتات.
- الثوابت يمكن ضبطها في تجارب النبات.
- المتغيرات التابعة يمكن قياسها بصورة أسهل في النباتات.
19.
- التواصل مع العلماء يوفر الوقت والجهد عليهم.
- ويمكن التواصل من خلال المواقع العلمية بالإنترنت أو المجلات أو الكتب أو البحوث والمحاضرات العلمية والندوات والاجتماعات.
20. الماء يحوي على قطبين موجب وأخر سالب، فيذيب الماء المركبات الأيونية كالتالي: ينجذب الأيون الموجب لقطب الماء السالب وينجذب الأيون السالب لقطب الماء الموجب.
21. لأن الماء هو المذيب فيها والغاز هو المذاب.
22. مع مرور الزمن ينطلق غاز ثاني أكسيد الكربون إلى الجو فتقل كمية المذاب في المذيب ويقل تركيز الغاز في المشروب الغازي.
⇐ درس مُقترح للمراجعة: حل المشكلات بطريقة علمية