عندما تكون المادة في حالتها السائلة، فإن لجزيئاتها طاقة حركية تُمكنها من التحرك فيما بينها، ولكن هذه الطاقة ليست كافية لتمكين تلك الجزيئات من التباعد تماماً عن بعضها.
انظروا إلى هذه الصورة؛ فقد تتحرك الجزيئات في اتجاه بعضها البعض، وربما تكون حركة الجزيئات أبطأ مما يؤدي إلى حدوث تدفق للجزيئات. ولكن الروابط بينها ما زالت قوية، حيث أن الجزيئات تبادل أماكنها مع غيرها.
لكن وجود روابط صغيرة بينها تجعلُها قريبة من بعضها، وإذا ارتفع متوسط الطاقة الحركية أو درجة الحرارة بقدرٍ كافٍ بحيث تفوق حرارة الاندماج، فإن الروابط بين الجزيئات لن تكون قوية بما يكفي لتُحافظ على تقاربها. بالتالي؛ تتفكك الجزيئات لتتحول إلى غاز، فتكتسب عندها الجزيئات الكثير من الطاقة الحركية بحيث تتحرك بحرية، وتتصادم ببعضها، وتأخذ شكل الوعاء الموجودة فيه.
وكما تعلمون فإن درجة الحرارة هي متوسط الطاقة الحركية KE أي أن؛ الطاقة الحركية لكل جزيء من هذه الجزيئات ليست متساوية، حيث تصطدم الجزيئات ببعضها البعض مثل كرات البلياردو.
حتى ينتقل الزخم إلى إحدى الجزيئات، فيكتسب المزيد من الطاقة الحركية. في حين تكون الطاقة الحركية لهذه الجزيئات الأخرى أقل.
ونُلاحظ أن الطاقة الحركية موزعة بشكل متباين بين الجزيئات. ونُلاحظ أيضاً أن جزيئات السطح تتبخر أولاً، وهي الأكثر قدرة على الابتعاد عن الجزيئات الأخرى للمادة، إذا اكتسبت طاقة حركية كافية.
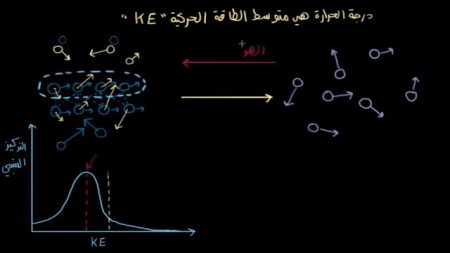
وفي المخطط البياني في الصورة نوضح الآتي:
المحور الأفقي يُمثل الطاقة الحركية، والمحور الرأسي يمثل التركيز النسبي ومتوسط الطاقة الحركية عند درجة حرارة ما، ومن هنا نرى أن الطاقة الحركية لكل الجزيئات تتوزع حول هذا المتوسط، لتُشكل منحنى على شكل جرس، وهو يمثل توزيعاً احتمالياً طبيعياً؛ حيث أنه يصبح أصغر فأصغر باتجاه الطاقة الحركية.
وقد يكون لبعض الجزيئات طاقة حركية منخفضة جداً، وهذا ما يجعلها تتحرك ببطء. وفي المقابل هنالك جزيئات ذات طاقة حركية عالية جداً، وقد يكون ذلك نتيجة للتصادم العشوائي بينها، وبين الجزيئات الأخرى. مما أعطاها سرعة متجهة، أو زخماً عالياً.
هل سرعة بعض الجزيئات وطاقتها الحركية كافية لتُمكنها من الابتعاد عن الجزيئات الأخرى؟
يُوضح الخط المرسوم باللون الأبيض في الرسم البياني في الصورة السابقة حد الطاقة الحركية الذي إن تجاوزته جزيئات السطح يكون بإمكانها التبخر والابتعاد عن الجزيئات الأخرى. قد يكون لهذا الجزيء في الأسفل طاقة حركية عالية، ولكن حتى يتمكن من الوصول إلى السطح والتبخر عليه أن يصطدم بجميع جزيئات السائل الأخرى التي تمر في طريقه.
لذا يصعب عليه أن يصل إلى جزيئات السطح التي تواجه الضغط الخارجي بشكل مباشر.
نفترض وجود غاز في الخارج وكثافته منخفضة، فجزيئات السطح هي وحدها القادرة على الانتقال إلى الهواء فوقها، ويعني ذلك؛ أن هناك جزءاً من جزيئات السائل قادر على التفكك والابتعاد عن الجزيئات الأخرى في أي وقت. أي أنه يتبخر أو يتحول إلى غاز، وتُسمى هذه العملية بالتبخر.
فمثلاً؛ لو تركتم ماء في الخارج، سيتبخر بمرور الوقت حتى لو كانت درجة حرارة المكان أقل من درجة الغليان الطبيعية للماء. وذلك لأن لبعض جزيئات الماء طاقة حركية عالية جداً، تُمكنها من الابتعاد عن باقي الجزيئات، والتبخر مبتعدة مع الهواء أو الرياح.
فتصعد جزيئات أخرى إلى السطح وتتبخر، وهكذا حتى يفرغ الوعاء من الماء.
ماذا يحدث للماء إذا كان في وعاء مغلق؟
في الوعاء المغلق الذي يحتوي ماءً يتعرض الماء لضغط الهواء فوقه، وجزيئات هذا الهواء لديها طاقة حركية، وكذلك الأمر بالنسبة لجزيئات الماء التي بدأ بعضها بالتبخر، أي أن؛ لبعض الجزيئات التي تظهر في التوزيع الاحتمالي طاقة حركية كافية للابتعاد والتبخر، والانتقال إلى جزيئات الهواء.
والرسم البياني في الصورة السابقة يمثل توزيع الطاقة الحركية للجزيئات وهي في الحالة السائلة، ويمكن تمثيل توزيع الطاقة الحركية للجزيئات في الحالة الغازية.
حيث أن الجزيئات في السائل تصطدم ببعضها فتكتسب أو تفقد طاقتها الحركية، وهذا ينطبق تماماً على الجزيئات المتبخرة في الأعلى، فمثلاً؛ قد يكون لبعض الجزيئات الكثير من الطاقة الحركية، إلا أنها تصطدم بشيء يجعلها تفقدها.
بالتالي؛ ينزل إلى الأسفل ويتحول من غاز إلى سائل، وهذا يعنى أن هناك عمليات تبخير وتكثيف مستمرة، بسبب تباين توزيع الطاقة الحركية بين الجزيئات.
ونُلاحظ أنه أثناء عملية انتقال المادة من بخار إلى سائل يفقد بعض البخار طاقته الحركية ليعود مرة أخرى إلى الحالة السائلة. كما أن سطح السائل قد يكتسب طاقة حركية، وذلك نتيجة للتصادمات العشوائية بين الجزيئات، مما يؤدي إلى تحوله إلى بخار، وتستمر عمليات التبخير هذه بالحدوث حتى يصل الماء إلى ما يسمى ب “حالة الإتزان” حيث أن هناك ضغطاً تسببه جزيئات البخار تلك الموجود في الأعلى.
ويُسمى هذا الضغط ب “ضغط البخار” وهو الضغط الذي ينشأ عند درجة حرارة معينة لجزيء معين، ولكل جزيء أو نوع من المادة ضغط بخار مختلف عند درجة حرارة مختلفة. وهذا الضغط ينتج عن جزيئات البخار عندما تكون في حالة اتزان. أي يكون عدد الجزيئات التي تتبخر، والتي تعود إلى الحالة السائلة متساوٍ.
وكلما ازداد الضغط صار من الصعب تبخر المزيد من الجزيئات. ففي حالات المادة إذا كان الماء عند درجة حرارة 100 سلسيوس وتحت ضغط عالي جداً فإنه يبقى في حالته السائلة.
والبخار يُنتج ضغطاً مع استمرار الماء في التبخر حتى يتساوى عدد الجزيئات المتحولة إلى البخار، وعدد الجزيئات المتحولة إلى سائل.
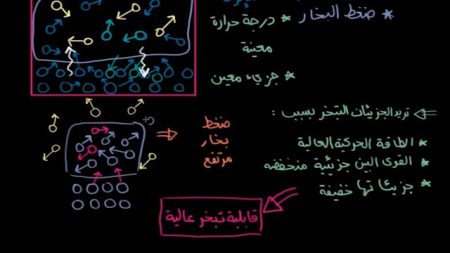
تتبخر الجزيئات بسبب:
- طاقتها الحركية العالية.
- القوى البين جزيئية لها منخفضة.
- جزيئاتها خفيفة.
وهو ما ينطبق على الهيدروكربونات والجازولين والميثان بسبب ضعف القوة البين جزئية فيها. أو لأن جزيئاتها خفيفة، والطاقة الحركية هي ناتج الكتلة والسرعة المتجهة. لذلك قد تكون الطاقة الحركية عالية نتيجة الكتلة الكبيرة والسرعة المتجهة المنخفضة.
بالتالي؛ إن كانت لديكم كتلة خفيفة بنفس الطاقة الحركية تكون السرعة المتجهة أعلى.
جزيئات المادة التي تريد التبخر تتحول إلى بخار حتى تصل الجزيئات إلى حالة الاتزان، بالتالي؛ لابد وأن يكون ضغط البخار الناشئ عن هذه الجزيئات المتبخرة مرتفعاً حتى تتمكن من الوصول إلى حالة الاتزان.
وإن كانت هذه المادة عند درجة حرارة منخفضة أو كانت القوى البين جزيئية فيها قوية، أو جزيئاتها ثقيلة، يكون الضغط البخاري فيها منخفض. فمثلاً؛ للحديد ضغط بخار منخفض جداً، لأنه لا يتبخر، في حين أن لثاني أكسيد الكربون ضغط بخار مرتفع، لأن الكثير من جزيئاته تتبخر.
والمادة التي لها ضغط بخار مرتفع وتميل جزيئاتها إلى التبخر لها قابلية تبخر عالية.
على سبيل المثال؛ الجازولين أكثر قابلية للتبخر من الماء، ولهذا فإن ضغط البخار فيه أعلى، لو وضعتم الجازولين في وعاء مغلق سيتحول عدد أكبر من جزيئاته إلى بخار مقارنة بالماء عند نفس درجة الحرارة.
وعلى جزيئات الجازولين توليد ضغط بخاري أكبر لتعادل قابلية الجازولين العالية للتبخر مقارنة بالماء.
ماذا يحدث إذا تساوى ضغط البخار مع الضغط الجوي؟
يوجد خارج الوعاء ضغط جوي بدرجة حرارة مُعينة، نفترض أنها درجة عالية، بحيث يُبقي الجزيئات داخل الوعاء، حتى وإن تبخر بعضها، لأن الضغط الجوي أعلى من ضغط البخار، وضغط البخار لجزيئات السطح يمثل مزيجاً من الضغط الجزئي للجزيئات الغلاف الجوي التي تتحول إلى سائل وضغط البخار.
وعندما يتساوى ضغط البخار مع الضغط الجوي؛ بحيث يكون لهما نفس مقدار القوة، تبدأ الجزيئات بالابتعاد، وتدفع الغلاف الجوي، فتُحدث فجوة، ويصل السائل درجة الغليان؛ حيث يتساوى فيه ضغط البخار مع الضغط الجوي.
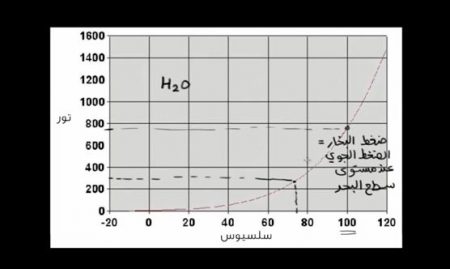
أمامكم في هذه الصورة رسم بياني يُمثل ضغط بخار الماء H2O، نُلاحظ أن ضغط بخار الماء عند درجة حرارة 100 سلسيوس يبلغ 760 تور، ويساوي 1 ضغط جوي عند مستوى سطح البحر، ويصل الماء عنده إلى درجة الغليان، وضغط بخار الماء البالغ 300 عند درجة حرارة أدنى هو أقل من الضغط الجوي.
إذا انخفض الضغط الجوي بالقدر الكافي، أو إذا فرغنا الهواء من الوعاء ليصل إلي نفس مستوى ضغط البخار في نقطة معينة مثلاً سيغلي الماء.
ويمكن لمادة أن تغلي عند درجة حرارة أقل، إذا انخفض الضغط الجوي إلى مستوى الضغط البخاري للمادة.
ونُلاحظ في الرسم البياني أن الزيادة في درجة حرارة ضغط البخار مطردة، فكلما زادت كمية الطاقة الحركية مع ارتفاع درجة الحرارة تغير شكل التوزيع الاحتمالي وأصبح أعلى.
ونُلاحظ أن عدد الجزيئات التي لديها ما يكفي من الطاقة الحركية للتبخر والابتعاد عن الجزيئات الأخرى أكبر.
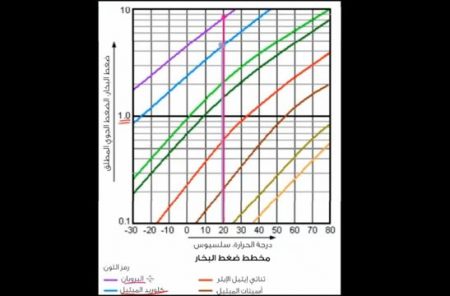
انظروا إلى المخطط اللوغاريتمي في هذه الصورة لضغط البخار لمواد أخرى، كالبروبان مثلاً؛ إذا كان البروبان عند حرارة معتدلة، ولتكن 20 سلسيوس فإن درجة البخار لديه يكون أعلى، حيث أنه يغلي عند درجة حرارة 20 سلسيوس ويتحول إلى غاز، وهذا لأن ضغط البخار لديه أعلى بكثير من الضغط الجوي عند سطح البحر.
ضغط بخار كلوريد الميثيل أقل من البروبان، إلا أن قابليته للتبخر عالية، وعند درجة حرارة 20 سلسيوس، عند مستوى سطح البحر، يغلي ويتحول إلى غاز.
ولإبقاء كلوريد الميثيل في الحالة السائلة أو حالة الاتزان بدلاً من الغليان والتحول إلى بخار، لابد أن يكون كلوريد الميثيل عند درجة حرارة -25 سلسيوس على الأقل.
في حين أن البروبان يبقى في الحالة الغازية عند هذه الدرجة، وذلك لأن ضغط البخار لديه أعلى.
أما البوتان مثلاً سيبقى في حالته السائلة، طالما أنه عند درجة حرارة 0 سلسيوس، ونُلاحظ من خلال المخطط تنوع ضغط البخار، وقابلية التبخر للمواد عند درجات الحرارة والضغط الجوي المختلفة.