للمادة -كما تعلمون- ثلاث حالات ألا وهي؛ الحالة الصلبة، والسائلة، والغازية. والماء هو خير مثال على هذه الحالات الثلاث؛ إذ أنه عند تبريده يتحول إلى الحالة الصلبة، أو الجليد، وعند تسخين الجليد يتحول إلى ماءٍ سائل، وعند تسخينه أكثر ينتقل إلى الحالة الغازية أو البخار.
ما الذي يجعل الماء صلباً أو سائلاً باختلاف درجة حرارته؟
يحتوي الماء على ذرة أكسجين وذرتين هيدروجين؛ وزوجين من إلكترونات التكافؤ في ذرة الأكسجين.
ونحن نعلم أن الأكسجين أعلى سلبية كهربائية أو كهرو سلبيه من الهيدروجين؛ أي أنه يحتكر الإلكترونات.
وبالنظر إلى الصورة التالية:
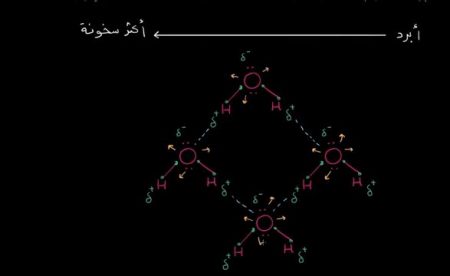
نُلاحظ أن الهيدروجين يساهم بإلكترون، والأكسجين كذلك، ولكن بما أن الأكسجين كهرو سلبي، فإنه يحتكر هذه الإلكترونات؛ مما يجعلها تحوم حول الأكسجين أكثر من الهيدروجين.
ونتيجة لذلك؛ نُلاحظ وجود شحنة جزئية سالبة عند طرف الأكسجين، وشحنة جزئية موجبة عند طرف جزيء الهيدروجين.
ونُلاحظ أن الأطراف الموجبة للهيدروجين تنجذب إلى الأطراف السالبة للأكسجين في الجزيئات الأخرى.
وبرسم المزيد من الجزيئات مع افتراض أن الهيدروجين يقع بالقرب من الأكسجين، ورسم جزيء آخر بالقرب من الجزيئات السابقة؛ حيث يكون لديكم ذرتين هيدروجين، وكذلك مع رسم الروابط القطبية أو الروابط الهيدروجينية؛ نرى أنها تبدأ بالتشكل بين الجزيئات. وبالتالي؛ تقوم الجزيئات بتكوين بنية شبكية.
نفترض أن الطاقة الحركية لتلك الجزيئات منخفضة؛ وهذا يعني أن هذه البنية الشبكية صلبة و ثابتة؛ حيث إن هذه الجزيئات لن تتحرك بالقرب من بعضها، وفي الحالة الصلبة كلما زادت الطاقة الحركية تزداد الحرارة.
مما يتسبب في اهتزاز الجزيئات قليلاً، لكنها لن تتحرك مع بعضها، فتحافظ على تماسكها، وبنيتها، وتحول هذه الحرارة والتي هي شكل من أشكال الطاقة إلى طاقة حركية تؤدي إلى اهتزاز هذه الجزيئات أكثر.
وعند وصول هذه الجزيئات إلى درجة كافية من الاهتزاز مع ارتفاع الحرارة والطاقة الحركية، تضعف الروابط القطبية بينها فلا تعود قادرة على احتواء الاهتزازات.
وتبدأ بالتحرك إلا أنها ما زالت منجذبة إلى بعضها، وعلى الرغم من أن الطاقة الحركية وصلت إلى نقطة تسببت فيها الاهتزازات بتفكك الروابط جزئياً بين الأطراف القطبية للجزيئات، إلا أن هذه الاهتزازات أو الطاقة الحركية لكل جزيء ليست قوية بما فيه الكفاية لإتمام تفكك تلك الروابط.
وتبدأ الجزيئات بالانزلاق فوق بعضها، وتتفكك البنية الشبكية الصلبة، فيتحول الصلب إلى سائل.
ومع أضافه المزيد من الحرارة والطاقة الحركية تتحول الجزيئات وتنفصل تماماً عن بعضها لتتحرك بشكلٍ مستقل، خاصة إن وجدت في الغاز المثالي. وقد تصطدم الجزيئات ببعضها، إلا أن الطاقة الحركية الكبيرة لكل جزيء تجعلها تتباعد عن بعضها.
الحالة الغازية من المادة وسبب صعوبة رؤيتها
السبب وراء صعوبة رؤية الغاز هو أن جزيئاته متباعدة عن بعضها، فلا تُرى في الضوء مثل السوائل، أو المواد الصلبة؛ إذ إن كثافة الماء في الحالة السائلة أكثر منها في الغازية، وفي الحالة الغازية تقفز الجزيئات ولا تلامس بعضها، ولهذا السبب يتسلل ضوء أكثر عبر المادة.
ملحوظة: التغير في الحرارة يرمز له بالرمز ΔH ، إذ أن دلتا Δ تعني التغير، والحرف H هو اختصار heat أي الحرارة.
والمحتوى الحراري هو المفهوم الذي يشير إلى التغير في الحرارة، وتذكروا أن الحرارة والطاقة الحركية ويرمز لها برمز KE والطاقة الكامنة ويرمز لها PE والمحتوى الحراري، وجميعها أشكال مختلفة للطاقة، وتقاس بوحدة الجول.
والطاقة تعني القدرة على القيام بالشغل، ووحدة الشغل هي الجول؛ أي القوة × المسافة.
وكلما أضفنا الحرارة إلى الماء ترتفع درجة حرارته، وكما تعلمون أن الحرارة هي متوسط الطاقة الحركية.
افترضوا أن الماء في الحالة الصلبة، فأضيفوا الحرارة إليه، ولاحظوا أن درجة حرارته ترتفع، وبما أن الحرارة شكل من أشكال الطاقة، وعند إضافتها إلى هذه الجزيئات ستهتز أو سترتفع طاقتها الحركية.
أي أن درجة الحرارة وهي مقياس متوسط الطاقة الحركية سترتفع أيضاً. إذا الماء في هذه الحالة في الطور الصلب أو الحالة الصلبة للمادة.
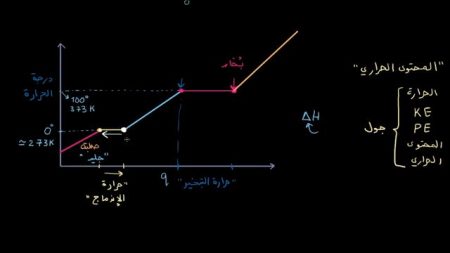
ماذا يحدث للماء عند درجة حرارة 0 سِلِسْيُوس Celsius والتي تساوي 273 كلفن تقريباً؟
يتحول الصلب إلى سائل أي يذوب الجليد، ويجدر التنبيه إلى أن هذا لا ينطبق على كل المواد الصلبة، إنما فقط على الماء في الحالة الصلبة أو الجليد.
إن ما يحدث عند درجة الصفر يعتمد على الاتجاه الذي تنتقل حالة الماء فيه؛ إما درجة تجمد الماء، أو درجة انصهار الجليد.
فعند إضافة المزيد من الحرارة للماء لا ترتفع درجة الحرارة، أي أنها تبقى ثابتة لفترة معينة، وبينما تكون درجة الحرارة ثابتة يبقى الماء في الحالة الصلبة.
ثم يتحول في النهاية إلى ماء سائل، وكلما زادت الحرارة سخن السائل أكثر حتى يصل إلى 100 Celsius أو 373 كلفن، وهي درجة تبخر أو غليان الماء.
وفي هذه الحالة تُصبح الطاقة الحركية للجزيئات عالية جداً، وكما حدث قبل الانتقال من الحالة الصلبة إلى السائلة يتحول الماء إلى بخار، ولكنه لا يزداد سخونة؛ أي أن درجة حرارته ثابتة لا ترتفع، ومع الاستمرار في إضافة الحرارة يصل الماء إلى التبخر بالكامل.
ثم تبدأ درجة حرارة البخار بالارتفاع، مع إضافة المزيد من الحرارة إلى النظام، نُلاحظ أن الحرارة التي نضيفها تتحول إلى طاقة حركية.
وكما تعلمون أن درجة الحرارة هي متوسط الطاقة الحركية، والحرارة هنا لم تكن تضيف طاقة حركية إلى النظام؛ أي أن درجة الحرارة لم تكن تتزايد، ولكن الجليد كان يتحول إلى ماء.
ما حدث في هذه الحالة هو أن الطاقة الحركية، أي الحرارة استُخدمت في تفكيك الروابط، ورفع مستوى حالة الطاقة للجزيئات، ولكن عند انتقال الجزيئات من الحالة الصلبة إلى السائلة، تبتعد الجزيئات عن بعضها لكنها تسعى في الوقت ذاته إلى السقوط في اتجاه بعضها، ولا تمكنها طاقتها الحركية العالية من ذلك، مما يرفع طاقتها الكامنة.
والحرارة التي كنا نُضيفها وتسمى بحرارة الاندماج، هي نفس كمية الحرارة بغض النظر عن اتجاه انتقال حالة المادة.
فعند انتفالها من الحالة الصلبة إلى الحالة السائلة تكون حرارة الانصهار، وهي الحرارة اللازمة لإذابة الجليد وتحويله إلى سائل. وعند تغير المادة من صلب إلى سائل تُستخدم الحرارة لإضافة طاقة كامنة إلى النظام. أو فصل الجزيئات عن بعضها. لمنحها طاقة كامنة إضافية.
فعند ابتعاد جسم ما عن الأرض يكتسب طاقة كامنة، وذلك لأن الجاذبية الأرضية تسحبه باتجاه الأرض، ويمكن لهذا الجسم القيام بالشغل أثناء سقوطه باتجاه الأرض.
كما يفعل الشلال حين يُحرك دولاب الماء حين سقوطه، وعندما يكون الماء في الحالة السائلة بالكامل ترتفع حرارته، والحرارة تُستخدم للطاقة الحركية.