إن جسمنا مؤلَّف من مجموعة كبيرة من المركبات العضوية، والمركب العضوي هو أي مادة كيميائية يدخل الكربون في تركيبها.
مميزات عنصر الكربون
يُعد الكربون عنصراً رائعاً لعدة أسباب، منها:
أولاً: الكربون عنصر صغير
فهو لا يحتوي على الكثير من البروتونات والنيوترونات، إذ يبلغ عددها في الغالب 12.
ولكن يمكن أن يحتوي على المزيد من النيوترونات في حالات نادرة كما هو الحال في نظائر الكربون في 13C أو 14C ونتيجة لصغر حجمه فهو لا يأخذ حيزاً كبيراً مما يجعله قادراً على تكوين أشكال عديدة فيُمكنه أن يُكوّن حلقات، ويمكنه أن يكون روابط ثنائية أو ثلاثية.
ويمكن أن يُشكل تراكيب لولبية أو صفائح أو غيرها من الأشكال المدهشة التي يصعب على الجزيئات الكبير تكوينها.
إذاً يمكن لعنصر الكربون تكوين كل هذه الأشكال المتنوعة نظراً لصغر حجمه.
ثانياً: عنصر الكربون مستقر نسبياً
فهو ليس كباقي العناصر التي تحتاج إلى اكتساب أو فقدان أو مشاركة إلكتروناتها للوصول إلى الرقم الذي تُريده.
الكربون يحتاج إلى الإلكترونات، ولكن ليس بنفس شدة حاجة عناصر مثل الكلور أو الصوديوم إلى الإلكترونات.
ولهذا السبب يكون للكلور آثار سلبية على الجسم عند استنشاقه في حالته الغازية، وعند أكل فلز الصوديوم فإنه سينفجر. أما الكربون فهو ليس سريع التفاعل لهذه الدرجة فهو يريد المزيد من الإلكترونات، ولكنه ليس بهذه الشدة.
كما أنه من السهل التفاعل مع الكربون حيث يمكنه تكوين وكسر أي عدد من الروابط بسهولة.
ثالثاً: يميل الكربون إلى الارتباط مع العديد من العناصر
لأنه يحتاج إلى أربعة إلكترونات إضافية. لذا فيمكنه الارتباط بأي عنصر قريب منه، وعادة ما يرتبط بعنصرين أو ثلاثة أو أربعة في نفس الوقت.
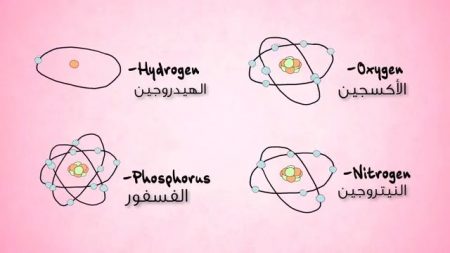
يمكن للكربون الارتباط مع الكثير من العناصر المختلفة؛ مثل الهيدروجين والأكسجين والفسفور والنيتروجين، وذرة الكربون الأخرى.
يمكن الكربون Carbon تشكيل عدد غير محدود من المركبات مما يجعله العنصر الأساسي في العديد من التراكيب المعقدة التي تدخل في تكوين الكائنات الحية كالإنسان، وبالتالي؛ نتيجة لصغر حجم عنصر الكربون، وقابليته الكبيرة للترابط مع الذرات الأخرى فهو عنصر أساسي للحياة.
يعد الكربون أهم عنصر في علم الأحياء، وهو ضروريُ جداً للحياة لدرجة أن العلماء لا يمكنهم تصور وجود حياة تأتي أساساً غير كربوني.
ويُشار أحياناً إلى السيلكون كعنصر مشابه للكربون بشكل كبير؛ حيث يعتقد العلماء أنه من العناصر التي يُحتمل أن تكون أساساً للحياة خارج كوكب الأرض.
ولكن السيليكون أكبر حجماً من الكربون، فلا يمكنه اتخاذ الأشكال التي تتخذها ذرة الكربون. كما أنه غير موجود في أي من الغازات.
فيما إنه إن كان أساساً للحياة بالفعل، فلذلك يعني أنه يجب تناول السيليكون الصلب في حين أن الحياة هنا على الأرض ممكنة لأن الكربون موجود في الهواء بشكل مستمر على هيئة ثاني أكسيد الكربون.
عنصر الكربون وارتباطه بالعناصر الأخرى
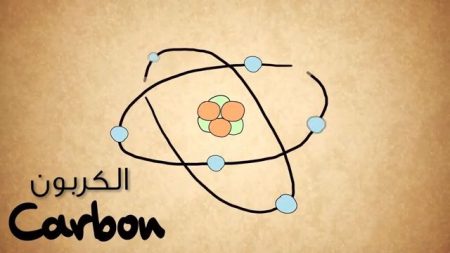
تتألف ذرة الكربون الواحدة من 6 بروتونات، و 6 إلكترونات و 6 نيترونات ولكل ذرة مدارات وأغلفة الكترونية، وتحتاج هذه الأغلفة إلى عدد من الإلكترونات ليُصبح المدار مكتملاً.
أول غلاف إلكتروني يسمى المدار S؛ وهو يحتاج إلى إلكترونين ليمتلئ، وهناك مدار ثانٍ S أيضاً وهو يحتاج الى إلكترونين. في ذرة الكربون تكون هذه المدارات ممتلئة.
أما المدار الثاني هو المدار P الذي يمتلئ بوجود 6 إلكترونات. يملك الكربون إلكترونين في هذا المدار، مما يعني إلى أنه يحتاج إلى أربعة إلكترونات أخرى.
يرتبط الكربون مع العديد من العناصر من خلال ما يعرف بالروابط التساهمية، وسميت بذلك لأن الذرات في هذه الروابط تتشارك الإلكترونات.
مركب الميثان
إن أبسط مركبات الكربون الميثان. مركب الميثان يتألف من ذرة كربون تشارك أربعة إلكترونات مع أربع ذرات هيدروجين.
والهيدروجين كما تعرفون لديه إلكترون واحد، فهو يحتاج إلى إلكترون آخر ليمتلئ مداره من النوع S لذلك يشارك الكربون إلكتروناته الأربعة مع 4 ذرات هيدروجين، وكل واحدة من ذرات الهيدروجين الأربعة تتشارك مع الكربون بإلكترون واحد، وبهذا تمتلئ مدارات جميع الذرات.
تركيب لويس النقطي
يمكن التعبير عما سبق باستخدام تركيب لويس النقطي. جيلبيرت لويس Gilbert Lewis وهو العالم الذي سُمي أحماض وقواعد لويس نسبة له كما تم ترشيحه لنَيل جائزة نوبل 35 مرة. ولكنه لم يفوز بها أبداً، فبالرغم من ترشحه لهذه الجائزة أكثر من أي عالم آخر في التاريخ، إلا أنه لم يفز بها إطلاقاً.
وهذا الأمر أزعج لويس كثيراً، فهو كان من أكثر علماء الكيمياء تأثيراً في زمنه. وهو أول من صاغ مصطلح الفوتو، واحدث ثورة في طريقة فهمنا للأحماض والقواعد.
كما أنتج أول جزيء من الماء الثقيل، وكان أول شخص يضع مفهوم الروابط التساهمية.
ولكنه كان شخصاً يصعب العمل معه، ولهذا أضطُر إلى الاستقالة من العديد من المناصب الهامة. كما لم يتم اختياره للمشاركة في مشروع مانهاتن Manhattan Project الذي عمل فيه زملائه من العلماء على تطوير أول الأسلحة النووية.
وتوفي لويس وحيداً في مختبره أثناء عمله على مركبات السيانيد بعد تناوله الغداء ما أحد زملائه الأصغر سناً الذي حاز على جائزة نوبل، وتم اختياره للعمل في مشروع مانهاتن.
يعتقد العديد أن لويس انتحر بمركبات السيانيد التي كان يعمل عليها، ولكن الطبيب الشرعي قال أنها نوبة قلبية دون أن يتحقق من الأمر.
وبذلك تدركون أن تركيب لويس النقطي هو من ابتكار عالم عبقري ومضطرب للغاية.
فهو ليس مجرد فكرة وجدت من تلقاء نفسها، هناك شخص ما فكر فيها وابتكارها، واتضح منذ ابتكارها أنها أداة مُفيدة جداً، ولذلك فهي ما زالت مستخدمة.
وفي علم الأحياء يتم استخدام تركيب لويس النقطي لإظهار شكل معظم المركبات.
قاعدة الثمانية
ومن أهم القواعد التي يجب تذكرها عند رسم هذه التراكيب هو أن بعض العناصر تميل إلى التفاعل مع بعضها البعض بطريقة تسمح لكل ذرة من امتلاك ثمانية إلكترونات في مدارها الأخير.
وتسمى هذه القاعدة بـ “قاعدة الثمانية” بأن هذه الذرات تريد أن تُكمل مداراتها الأخيرة، وتملاها بثمانية الكترونات لتُصبح أكثر استقراراً.
يحتوي على الأكسجين على 6 إلكترونات في مداره الأخير مما يعني أنه يحتاج إلى إلكترونين فقط، ولهذا السبب يرتبط مع ذرتين هيدروجين في جزيء الماء H2O كما يمكن للأكسجين الارتباط بالكربون الذي يحتاج إلى أربع إلكترونات، فيرتبط الكربون مع ذرتين من الأكسجين برابطتين مزدوجتين، ويكون الناتج ثاني أكسيد الكربون CO2، المعروف الآن بغاز الاحتباس الحراري، والأهم من ذلك فهو الغاز الذي تستخدمه النباتات لضمان بقاء الحياة على الأرض.
عنصر النيتروجين
أما النيتروجين فيحتوي على 5 إلكترونات في مداره الأخير. وكما يُفضل للأشخاص الذين يستقلون الحافلة الجلوس بجانب بعضهم البعض، كذلك الإلكترونات في هذا المدار، فهي أيضاً لا تترتب بشكل مزدوج إلا إذا لزم الأمر.
وبالتالي للوصول إلى الحالة القصوى من الاستقرار يرتبط النيتروجين مع 3 ذرات هيدروجين مكوناً ألمونيا.
الحمض الأميني
يرتبط النيتروجين مع ذرتي هيدروجين ومجموعة أخرى من الذرات التي تُسمى المجموعة الأمينية. وإن كانت تلك المجموعة الأمينية مرتبطة بكربون مرتبط بمجموعة كربوكسيلية سيتكون ما يُعرف بالحمض الأميني.
وفي بعض الأحيان يتم تشارك الإلكترونات بتساوٍ ضمن الرابطة التساهمية كما هو الحال في غاز الأكسجين، وتُسمى هذه الحالة بالرابطة التساهمية غير القطبية، لكن في معظم الأحيان يكون أحد الذرات أكثر جشعاً من الآخر.
فعلى سبيل المثال؛ في الماء يسحب جزيء الأكسجين الإلكترونات نحوه فتبقى حوله لوقت أطول من الوقت التي تكون فيه حول ذرتي الهيدروجين. مما يولد شحنة جزئية موجبة حول الهيدروجين، وشحنة جزئية سالبة حول الأكسجين.
الرابطة التساهمية القطبية
عندما يحمل جزيء شحنة ما نقول أنه قطبي، أي أن لديه قطب موجب وقطب سالب، وهذه هي الرابطة التساهمية القطبية.
أما الروابط الأيونية فلا تتكون عن طريق مشاركة الذرات للإلكترونات، بل تنشأ هذه الروابط بين الذرات إما عن طريق منح الذرة للإلكترونات، أو اكتسابها من ذرة أخرى.
وتُصبح بذلك ذرة مشحونة أو ما يُسمى بالأيونات، وبشكل عام يُفضل أن تكون الذرات متعادلة، ولكنها تُفضل أكثر أن تكون مداراتها الأخيرة مكتملة.
كلوريد الصوديوم؛ ملح الطعام
من أكثر المركبات الأيونية شيوعاً واستخداماً في الحياة اليومية هو ملح الطعام NaCl أو كلوريد الصوديوم، يتكون كلوريد الصوديوم من عنصرين خطيرين جداً، وهما الكلور والصوديوم، وعنصر الكلور هو هالوجين؛ أي أنه يحتاج فقط إلى بروتون واحد لمداره الأخير.
أما الصوديوم فهو فلز قلوي، أي لديه إلكترون واحد فقط في مداره الأخير، ويُمكن لهذين العنصرين تدمير أي مركب كيميائي يكون في طريقهما بهدف تحقيق قاعدة الثمانية.
ويُعد ارتباط الصوديوم بالكلور هو الحل الأمثل لهذين العنصرين حيث يتبادلان الإلكترونات على الفور. فيفقد الصوديوم إلكتروناته الزائدة، ويملأ الكلور مداره الأخير بالإلكترون الثامن الذي اكتسبه من الصوديوم، وبالتالي؛ نحصل على NaCl.
ونتيجة لقوة هذه الشحنات فهي تلتصق ببعضها، وهذا الالتصاق هو ما يُسمى بـ “الرابطة الأيونية”.
وهذه التغيرات الكيميائية لها تأثير واضح؛ حيث يتحول الصوديوم والكلور من مركبات خطيرة إلى مركب يُمكن تناوله.
هناك كذلك الروابط الهيدروجينية؛ فهي في الحقيقة ليست روابط فعلية. وفي بعض الأحيان تكون الروابط الأيونية أبطأ من الروابط التساهمية. وذلك أمر استثنائيٌ وليس بقاعدة.
تتفاوت قوة الروابط التساهمية بشكل كبير. إن طريقة تكوين أو تكسير تلك الروابط هو أمرٌ في غاية الأهمية، فهو يؤثر بشكل مباشر على حياتنا؛ حيث يُعد تكوين وكسر الروابط مفتاح الحياة.
فعلى سبيل المثال؛ في حال ابتلاع القليل من معدن الصوديوم فهو مفتاح الموت، فحاولوا أن تتذكروا هذه المعلومات عن المعادن والذرات.