لدراسة علم الكيمياء عليكم البدء بأكثر الأمور دقة، وأكثر المواضيع إثارة للجدل ألا وهي الذرة؛ لقد شارك العديد من الفلاسفة قديما بتفسير مفهوم الذرة، ومما ما وصلوا إليه الفرضية التالية:
لو أن لديكم تفاحة وقطعتموها إلى قطع صغيرة؛ إلى قطع أصغر أكثر وأصغر وأصغر ستحصلون في النهاية على قطعة بالغة الصِّغر لا يمكنكم تقطيعها أكثر.
وأطلق هؤلاء الفلاسفة على هذه القطعة متناهية الصغر التي لا يمكن تقطيعها بتاتاً؛ أطلقوا عليها اسم الذرة، وتطبق هذه الفكرة على كل المواد والعناصر الموجودة في الكون ليس فقط على التفاحة.
معنى كلمة الذرة
كلمة الذرة تعني باليونانية الشيء غير القابل للقطع أو التقسيم، لكن في الوقت الحاضر تعرفون أنها تُجزء وتقسم، وأنها ليست شيئاً بسيطاً، وأيضاً ليست أصغر المكونات على الإطلاق.
بل هي تتكون من جسيمات، وأجزاء أساسية أصغر؛ وهي النيوترونات والبروتونات والإلكترونات.
وكان التصور القديم أنها تجتمع معاً، ففي منتصف الذرة توجد النواة التي تحوي البروتونات والنيوترونات. أما الإلكترونات فكان الاعتقاد أنها تدور حول النواة ضمن مدارات محددة تُشبه نوعاً ما دوران الكواكب حول الشمس.
إلا أن هذا التشبيه لحركة الإلكترونات حول النواة خاطئ، وستعرفون التصور الصحيح لحركة الإلكترونات عند دراستكم لميكانيكا الكم.
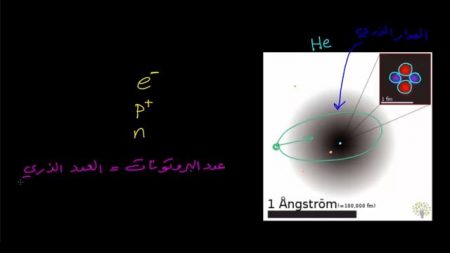
وهذه فكرة أولية حول تكوين الذرة، أما التطور الأصح والأدق للذرة فهو كما ترون في هذه الصورة
ترون فيها ذرة هيليوم، وفيها بروتونان اثنان ونيوترونات اثنان أيضاً. هذه الحمراء هي البروتونات والبنفسجية هي نيوترونات، وهي تقع في منتصف الذرة. أما الجزء الضبابي حولها فهوة اثنان من الإلكترونات التي تحملها هذه الذرة.
وسبب ظهور هما في هذا الشكل الضبابي، وليس في شكل مدارات تقليدية كالرسم الأول يعود إلى أنه؛ لا يمكن معرفة مكان وزخم حركة الإلكترونات حول النواة.
المدار الذري
كل ما يمكن معرفته هو توزيع المواقع المحتملة لوجودها؛ فاللون الأسود يمثل الأماكن ذات الاحتمال الأكبر؛ أي أن احتمال إيجادها في مكان ما أكبر من احتمال إيجادها في مكان آخر.
لكنها قد تكون في أي مكان حتى في الجزء الأبيض تماماً. هناك احتمالية لكنها ضعيفة جداً؛ إن الاقتران أو الدالة التي تبين احتمالية توزيع الإلكترونات حول النواة تسمى المدار الذري.
تذكروا المدار في التصور القديم هو أن يدور الإلكترون حول النواة كدوران الكواكب حول الشمس. أما المدار الذري فهو دالة رياضية تصف حركة الإلكترونات في الذرة أو احتمالات مواقع وجودها.
ولاحظوا أن سلوك الإلكترون غريب، فمع أنه يُعد جُسيماً إلا أنه لا يمكن تحديد مكانه في هذا الفراغ الضبابي.
كما أن هناك أشكال عدة لهذه المساحة الضبابية تعتمد على عدد الإلكترونات في الذرة.
واقرأ هنا أيضًا عن ميل محور الأرض والفصول الأربعة
قانون كولوم والشحنة السالبة والموجبة
إن المفهوم العام حول الإلكترونات والبروتونات قائماً على فكرة الشحنة، والذي تعرفتم عليه في الدروس المتعلقة بقانون كولوم في الفيزياء، والذي ينص على أن الإلكترون له شحنة سالبة، والبروتون له شحنة موجبة.
أما النيوترون فلا يحمل شحنة، وهذا يتماشى مع التصور الأولي؛ إذ تكون شحنة في النواة موجبة والشحنات الأخرى سالبة فيتجاذب الطرفان.
وإذا كان للإلكترونات سرعة كافية معينة؛ فإنها ستدور حول النواة كما تدور الكواكب. لكننا نعرف أن هذا التصور ليس صحيحاً كلياً؛ لأنه كلما ابتعد الإلكترون عن النور زادت طاقته الكامنة؛ أي أنه يميل للانجذاب والاتجاه نحو النواة.
لكن وفق فرضيات ميكانيكا الكم لا يمكنه ذلك، بل يتحرك في مجال محدد، وتزداد طاقته كلما زاد بعد مداره الذري.
ويمكنكم معرفة العنصر وتحديده من خلال عدد البروتونات، ويُسمى عدد البروتونات بالعدد الذري.