
بطاقة الدرس:
- عنوانه: تركيب الذرة والتوزيع الالكتروني.
- ترتيبه: الأول من الوحدة الثانية «الذرّة والجدول الدوري».
- مادة: العلوم.
- الصف: الثامن الأساسي.
- الفصل الدراسي: الأول.
- المدارس: الأردنية.
- الهدف: تلخيص/مراجعة وحل أسئلة.
- الدرس السابق «والأخير من الوحدة الأولى»: الوراثة
المادة ومكوناتها
- المادة: كل شيء له كتلة ويشغل حيزاً في الفراغ، وأدركه بحواسي. تتكون المادة سواء أكانت صلبة أم سائلة أم غازية، من ثلاثة أشكال هي: العناصر والمركبات والمخاليط.
- العنصر: مادة تتكون من نوع واحد فريد من نوعه من الذرات.
- الذرة: أصغر جزء من المادة وغير قابلة للتقسيم بالطرائق الفيزيائية والكيميائية البسيطة. فعلى سبيل المثال يتكون عنصر الحديد من ذرات الحديد والألمنيوم من ذرات الألمنيوم.
ولكل عنصر اسم ورمز خاصان به الرموز، والجدول التالي يتضمّن رموز بعض العناصر المشهورة.
| العنصر | رمزه | العنصر | رمزه | العنصر | رمزه | العنصر | رمزه |
| الهيدروجين | H | اليود | l | الأكسجين | O | الكربون | C |
| الصوديوم | Na | الفضة | Ag | الباريوم | Ba | الرصاص | Pb |
| البوتاسيوم | K | المغنسيوم | Mg | الزئبق | Hg | الكبريت | S |
| الفلور | F | الكالسيوم | Ca | الحديد | Fe | الألومنيوم | Al |
| الكلور | CI | الخارصين | Zn | الكروم | Cr | النيتروجين | N |
| البروم | Br | النحاس | Cu | السليكون | Si | الفسفور | P |
مكونات الذرة Components of Atoms
تتكون ذرة أي عنصر من ثلاثة جسيمات متناهية في الصغر هي:
- البروتونات (P): أجرى العالم رذرفورد تجارب أثبت من خلالها أن معظم حجم الذرة فراغ، وأن كتلة الذرة تتمركز في حيز صغير سماه النواة، يوجد بداخلها جسيمات غير مرئية متناهية في الصغر تحمل شحنة موجبة تسمى البروتونات، ويرمز له بالرمز.(P).
- النيوترونات (n): اكتشف العالم شادويك من خلال التجارب وجود جسيمات غير مرئية توجد داخل النواة اطلق عليها اسم النيوترونات، وهي جسيمات متناهية في الصغر ومتعادلة لا تحمل أي شحنة، وكتلة النيوترون تساوي كتلة البروتون تقريباً ويرمز له بالرمز (n).
- الإلكترونات (e): اكتشف العالم ثومسون وجود جسيمات غير مرئية متناهية في الصغر تحمل شحنة سالبة تسمى الإلكترونات تدور في فراغ حول النواة ويرمز لها بالرمز – e، وشحنة الإلكترون مساوية لشحنة البروتون، لكنها سالبة وتجعل الذرة مستقرة ومتعادلة، وكتلة الإلكترون أقل بكثير من كتلة البروتون.
نوى الذرات تختلف فيما بينها
لكل عنصر ذراته المميزة، فذرات العناصر المختلفة تختلف فيما بينها في عدد البروتونات، فلا ذرتان متشابهتان في عدد البروتونات.
العدد الذري Atomic Number
إن عدد البروتونات في الذرة يميز ذرات العنصر من غيره من العناصر، وهو ما يُسمى العدد الذري للعنصر، ويُعد العدد الذري هوية العنصر، إذ تعتمد خصائص العنصر عليه، ولا يوجد عنصران متساويان في العدد الذري لهما.
العدد الذري: هو عدد البروتونات الموجودة في نواة ذرة العنصر.
العدد الذري للعنصر = عدد البروتونات = عدد الإلكترونات في الذرة المتعادلة.
مثلاً، يوجد في نواة عنصر الهيدروجين بروتون واحد؛ لذا يكون العدد الذري للهيدروجين (1)، ويكون عدد الإلكترونات (1) وهذا ما يجعل الذرة متعادلة.
العدد الكتلي Mass Number: هو مجموع عدد البروتونات والنيوترونات الموجودة داخل نواة ذرة العنصر.
العدد الكتلي = عدد البروتونات + عدد النيوترونات = n + P ويمكن التعبير عن العدد الذري والعدد الكتلي لأيّ عنصر برمز Na.
النظائر Isotopes: إن ذرات العنصر الواحد لها عدد ثابت من البروتونات، لكنها قد تختلف في عدد النيوترونات فيها، وتسمى ذرات العنصر الواحد التي تختلف في عدد النيوترونات وتتشابه في عدد البروتونات بالنظائر.
ويمكن أن تكتب نظائر الكربون على النحو الآتي:
![]()
ونظائر البوتاسيوم على النحو الآتي:
![]()
نظائر الكربون:
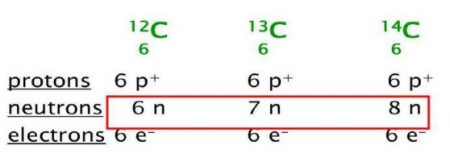
نظائر الكربون التي تختلف في عدد النيوترونات.
ما عدد نيوترونات ذرة العنصر يساوي 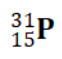
التوزيع الالكتروني للذرات Electron Distribution of Atoms
يُطلق على المناطق الموجودة حول نواة الذرة والتي توجد فيها الإلكترونات مستويات الطاقة.
يتسع كل مستوى لعدد محدد من الإلكترونات. فمستوى الطاقة الأول يتسع لإلكترونين ويرمز له بالرمز n1، أما مستوى الطاقة الثاني فيتسع لثمانية إلكترونات ويرمز له بالرمز، n2، في حين يتسع مستوى الطاقة الثالث لـ 18 إلكترون بحسب العلاقة.
مثال: بين التوزيع الالكتروني لعنصر الصوديوم ( عدده الذري = 11).
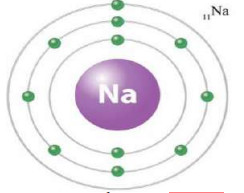
ويمكن التعبير عن هذا التوزيع رقمياً على النحو الآتي: (11Na : 2,8,1)
وسوف نعتمد هذه الطريقة؛ لأنها أبسط من الرسم الكامل، وذلك لغرض السرعة واختصار الوقت والجهد.
سؤال: مستعيناً بالشكل أجب عما يلي:
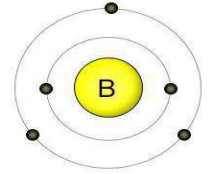
- ما العدد الذري لذرة العنصر؟
- عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي.
- ما عدد مستويات الطاقة؟
- أكتب التوزيع الالكتروني؟
- ما اسم العنصر؟
سؤال: أكتب التوزيع الإلكتروني لذرة الأرغون ![]() ثم أجب عما يلي:
ثم أجب عما يلي:
- العدد الذري:
- عدد البروتونات:
- عدد مستويات الطاقة:
- العدد الكتلي:
- عدد النيوترونات:
- عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي:
سؤال: اكتب التوزيع الالكتروني لكل مما يأتي?
- 35Br:
- 14Si:
- 8O:
- 13AI:
- 19K:
- 20Ca:
- 3Li:
- 12Mg:
إجابات أسئلة مراجعة الدرس ص58
س: أعدد مكونات الذرة الرئيسة، وخاصية مميزة واحدة لكل منها?
الإجابة:
- الإلكترونات: جسيمات سالبة الشحنة تدور حول نواة الذرة.
- بروتونات: جسيمات موجبة الشحنة توجد داخل نواة الذرة.
- نيوترونات: جسيمات متعادلة توجد داخل نواة الذرة.
س: أحدد عدد الإلكترونات في ذرة متعادلة تحتوي على 58 بروتون؟
ج: 58 إلكترون؛ لأن عدد البروتونات = عدد الإلكترونات في الذرة المتعادلة.
س: أفسر: وجود أكثر من نظير للعنصر نفسه؟
ج: لاختلافها في عدد النيوترونات في أنويتها.
س: أصف الفرق بين العدد الكتلي، والعدد الذري للذرة؟
الإجابة:
- العدد الذري للذرة: يساوي عدد البروتونات، ويساوي عدد الإلكترونات في الذرة المتعادلة.
- العدد الكتلي: هو مجموع مكونات النواة (البروتونات والنيوترونات).
س: مثل التوزيع الإلكتروني لذرة P15؟
ج: 15P: 2 , 8 , 5.
س: أستنتج: في ضوء دراستي للذرة ومكوناتها، أي الجمل الآتية صحيحة، وأيّها غير صحيحة؟
- تُعدّ الذرة الجسيم غير القابل للتقسيم. غير صحيحة
- توجد الجسيمات الثلاثة المكونة للذرة جميعها في داخل نواة محلها. غير صحيحة
- يشبه عدد البروتونات لكل ذرة بصمة الأصبع للإنسان. صحيحة
- يساوي العدد الكتلي لأيّ ذرة مجموع عدد إلكترونات الذرة وعدد بروتوناتها. غير صحيحة
س: أفكر: عندما أريد ربط عدة أشياء معاً، قد أستخدم أربطة مطاطية أو سلكاً أو شريطاً أو صمغاً. ولكن ما الذي يربط البروتونات والنيوترونات معاً داخل النواة؟
ج: يوجد قوى تربط مكوناته النواة مع بعضها تسمى قوى الربط النووي.
س: التفكير الناقد: اجتهد العلماء في البحث وإجراء التجارب على الذرة ومكوناتها من الجسيمات، وإجراء الحسابات لكتل هذه الجسيمات. أوضح كيف يمكن لذرتين من العنصر نفسه أن يكون لهما كتلتان مختلفتان؟
ج: يمكن أن تختلف ذرتان من العنصر نفسه في الكتلة إذا كانتا من نظائر العنصر، فاختلاف الذرتين في عدد النيوترونات يؤثر في كتلة كل منهما.
تطبيق الرياضيات:
العدد الكتلي لذرة متعادلة (لا تحمل أي شحنة) لأحد العناصر يساوي 27، علماً أن نواتها تحتوي على 14 نيوترون. أحسب عدد إلكتروناتها؟
ج: العدد الكتلي = عدد البروتونات + عدد النيوترونات.
27 = عدد البروتونات + 14.
عدد البروتونات = 13 = عدد الإلكترونات؛ لأن الذرة متعادلة.
⇐ ولا تنسى أيضًا الاطلاع: حل أسئلة الوحدة 1 «الوراثة والتكاثر» علوم 8 أساسي «أردني» الفصل الأول