فيمبات أقراص مغلفة Vimpat tablets / لاكوساميد Lacosamide
تحتوي هذه الصفحة على معلومات تفصيلية ومُنقّحة عن دواء Vimpat بكل ما يتعلق بهِ.
1. اسم المنتج الدوائي
فيمبات 50 ملغ أقراص مغلفة.
فيمبات 100 ملغ أقراص مغلفة.
فيمبات 150 ملغ أقراص مغلفة.
فيمبات 200 ملغ أقراص مغلفة.
2. التركيب النوعي والكمي
يحتوي كل قرص مغلف على 50 ملغ من لاكوساميد.
يحتوي كل قرص مغلف على 100 ملغ من لاكوساميد.
يحتوي كل قرص مغلف على 150 ملغ من لاكوساميد.
يحتوي كل قرص مغلف على 200 ملغ من لاكوساميد.
لمعرفة القائمة الكاملة لمواد السواغ، انظر القسم 6.1.
3. الشكل الصيدلاني
Vimpat هو أقراص مغلفة
أقراص فيمبات 50 ملغ ذات لون وردي، وهي أقراص مغلفة بيضاوية الشكل منقوش عليها ’ SP ‘من ناحية، و‘ 50 ’ من الناحية الأخرى.
أقراص فيمبات 100 ملغ ذات لون أصفر قاتم، وهي أقراص مغلفة بيضاوية الشكل منقوش عليها ’ SP ‘ من ناحية، و‘ 100 ’ من الناحية الأخرى.
أقراص فيمبات 150 ملغ ذات لون قرنفلي فاتح، وهي أقراص مغلفة بيضاوية الشكل منقوش عليها ‘ SP ’ من ناحية، و‘ 150 ’ من الناحية الأخرى.
أقراص فيمبات 200 ملغ ذات لون أزرق، وهي أقراص مغلفة بيضاوية الشكل منقوش عليها ‘ SP ’ من ناحية، و‘ 200 ’ من الناحية الأخرى.
4. التفاصيل الإكلينيكية
4.1 دواعي استعمال Vimpat العلاجية
يُستعمل فيمبات Vimpat كعلاج مساعد في علاج بداية النوبات الصرعية الجزئية المصحوبة بتعميم ثانوي أو غير المصحوبة به لدى المرضى البالغين والمراهقين (الذين تتراوح أعمارهم ما بين 16 إلى 18 عامًا) المصابين بالصرع.
4.2 الجرعة وطريقة التناول
الجرعة
يجب تناول لاكوساميد مرتين يوميًا (مرة واحدة عادةً في الصباح ومرة في المساء). وتبلغ جرعة البدء الموصي بها 50 ملغ مرتين يوميًا، مع مراعاة زيادتها إلى جرعة علاجية أولية تبلغ 100 ملغ مرتين يوميًا بعد مرور أسبوع واحد.
كما يمكن بدء العلاج بلاكوساميد بجرعة تحميل مفردة تبلغ 200 ملغ، يليها بعد 12 ساعة تقريبًا نظام جرعة مداومة تبلغ 100 ملغ تُعطى مرتين يوميًا ) 200 ملغ/يوم).
يمكن البدء بجرعة تحميل للمرضى في حالات يقرر فيها الطبيب أن الوصول السريع إلى تركيز لاكوساميد في البلازما عند حالة الثبات والتأثير العلاجي مضمونان. ويجب إعطاؤه تحت إشراف طبي مع الأخذ في الاعتبار احتمالية زيادة حدوث تفاعلات عكسية في الجهاز العصبي المركزي (انظر قسم 4.8 ). لم تتم دراسة إعطاء جرعة تحميل في حالات حادة مثل الحالة الصرعية.
وفقًا للاستجابة والتحمل، يمكن زيادة جرعة المداومة بشكل أكبر بمقدار 50 ملغ مرتين يوميًا كل أسبوع، لتصل إلى أقصى جرعة يومية موصى بها وهي 400 ملغ ) 200 ملغ مرتين يوميًا). ويمكن تناول لاكوساميد مع الطعام أو بدونه.
ووفقًا للممارسة الإكلينيكية الحالية، إذا كان من الضروري إيقاف العلاج بلاكوساميد، فإنه يوصى بأن يتم ذلك تدريجيًا (كأن يتم مثلاً إنقاص الجرعة اليومية تدريجيًا بمقدار 200 ملغ/أسبوع).
مجموعات المرضى الخاصة
كبار السن (الذين تزيد أعمارهم على 65 عامًا).
لا يستلزم الأمر تقليل الجرعة للمرضى من كبار السن. وجديرٌ بالذكر أن التجارب التي أجريت على استخدام لاكوساميد مع المرضى من كبار السن المصابين بالصرع محدودة.
يجب أخذ التصفية الكلوية المنخفضة المرتبطة بالسن مع الزيادة في مستويات المنطقة تحت المنحنى في الاعتبار لدى المرضى من كبار السن (انظر الفقرة التالية «القصور الكلوي » والقسم 5.2).
القصور الكلوي
لا يستلزم الأمر تعديل الجرعة للمرضى المصابين بقصور كلوي خفيف ومتوسط (تصفية الكرياتينين < 30 مللي لتر/دقيقة). بالنسبة للمرضى المصابين بقصور كلوي خفيف أو متوسط، من الممكن أخذ جرعة التحميل بمقدار 200 ملغ في الاعتبار، ولكن لا بد من زيادة معايرة الجرعة (< 200 ملغ يوميًا) بحذر.
أما بالنسبة للمرضى المصابين بقصور كلوي شديد (تصفية الكرياتينين ≥ 30 مللي لتر/ دقيقة) والمرضى المصابين بمرض كلوي في مراحله المتأخرة، فيوصى بجرعة مداومة قصوى تبلغ 250 ملغ/يوم. وبالنسبة لهؤلاء المرضى، فينبغي معايرة الجرعة بحذر. إذا وُصفت جرعة تحميل، فينبغي اتباع نظام يتم فيه تناول جرعة أولية تبلغ 100 ملغ متبوعة ب 50 ملغ مرتين يوميًا في الأسبوع الأول. بالنسبة للمرضى الذين يحتاجون إلى غسيل كلوي، يوصى بمكمل يصل إلى 50 % من الجرعة اليومية المقسمة بعد نهاية جلسة الغسيل الكلوي مباشرة. ينبغي توخي الحذر عند علاج المرضى المصابين بمرض كلوي في مراحله المتأخرة لقلة التجارب الإكلينيكية وتراكم أحد المستقلبات (ليس له نشاط دوائي معروف).
القصور الكبدي
لا يستلزم الأمر تعديل الجرعة بالنسبة للمرضى المصابين بقصور كبدي خفيف إلى متوسط.
وبالنسبة لهؤلاء المرضى، فينبغي معايرة الجرعة بحذر مع أخذ القصور الكلوي المصاحب في الاعتبار. ربما يتم أخذ جرعة تحميل تبلغ 200 ملغ في الاعتبار، ولكن ينبغي زيادة معايرة الجرعة (< 200 ملغ) بحذر. لم يتم تقييم الحرائك الدوائية للاكوساميد لدى المرضى المصابين بقصور كبدي شديد (انظر القسم 5.2 ).
المرضى الأطفال: لم يتحدد بعد أمان دواء لاكوساميد وفعاليته مع الأطفال البالغ أعمارهم أقل من 16 عامًا. ولا توجد بيانات متوفرة. طريقة التناول: تستخدم أقراص لاكوساميد المغلفة عن طريق الفم. ويمكن تناول لاكوساميد مع الطعام أو بدونه. 4.3 موانع الاستعمال: الحساسية المفرطة للمادة الفعالة أو لأى من مواد السواغ المذكورة في قسم 6.1. الإحصار الأذيني البطينى المعروف من الدرجة الثانية أو الثالثة.
4.4 تحذيرات واحتياطات خاصة للاستخدام التفكير في الانتحار والسلوك الانتحاري قد تم الإبلاغ عن التفكير في الانتحار والسلوك الانتحاري لدى المرضى الذين يتم علاجهم بأدوية مضادة للصرع في العديد من دواعي الاستعمال. وقد أظهر التحليل الجمعي للتجارب العملية العشوائية لمضادات الصرع المستخدم بها العلاج الوهمي زيادة الخطورة في التفكير في الانتحار والسلوك الانتحاري. إن آلية هذه الخطورة غير معروفة، والبيانات المتاحة لا تستبعد إمكانية زيادة خطورة اللاكوساميد. ولذلك تنبغي مراقبة المرضى لظهور علامات تدل على التفكير في الانتحار والسلوك الانتحاري، والنظر في العلاج المناسب. ويجب نصح المرضى (ومقدمي الرعاية للمرضى)بطلب المشورة الطبية عند ظهور أعراض التفكير في الانتحار والسلوك الانتحاري (انظر القسم 4.8). نظم وإيصال القلب قد لوحظ وجود إطالة لفترة PR ، مع استخدام اللاكوساميد في الدراسات الإكلينيكية. يجب استخدام اللاكوساميد بحذر للمرضى المعروفين بوجود مشاكل في الإيصال، أو مرض قلبي حاد مثل الاحتشاء في عضلة القلب، أو فشل القلب الكلي. ينبغي الحذر خصوصًا عند علاج المرضى كبار السن؛ لأنه ربما يكون هناك خطر متزايد للإصابة باضطرابات قلبية، أو عندما يُستخدم اللاكوساميد مع مجموعة من المنتجات المعروفة بارتباطها بإطالة فترة PR. وقد تم الإبلاغ عن الإصابة بالدرجة الثانية، أو الدرجات العليا من الإحصار الأذيني البطيني في تجارب ما بعد التسويق. في التجارب العملية للاكوساميد التي تم استخدام العلاج الوهمي بها للمرضى المصابين بالصرع، لم يتم الإبلاغ عن الإصابة بالرجفان الأذيني، أو الرفرفة الأذينية؛ ولكن تم الإبلاغ عن كليهما في تجارب صرع معروفة الدواء وفي تجارب ما بعد التسويق (انظر القسم 4.8 ). وينبغي أن يكون المرضى على وعي بأعراض المرحلة الثانية، أو المراحل المتقدمة من الإحصار الأذيني البطيني (على سبيل المثال: النبض البطيء أو غير المنتظم، الشعور بالدوار أو الإغماء)، وأعراض الرجفان الأذيني، والرفرفة الأذينية (على سبيل المثال: الخفقان، والنبض السريع أو غير المنتظم، وضيق التنفس). وينبغي نصح المرضى لطلب المشورة الطبية عند حدوث أي من هذه الأعراض. الدوار قد ارتبط العلاج باللاكوساميد بالدوار، الذي يمكن أن يزيد من احتمالات حدوث إصابات عرضية، أو السقوط. ولذلك ينبغي أن يُنصح المرضى بتوخي الحذر عند القيام بالتمارين حتى يعتادوا على الآثار المحتملة للدواء (انظر القسم 4.8 ).
4.5 التفاعل مع المستحضرات الدوائية الأخرى وأشكال التفاعل الأخرى: ينبغي استعمال لاكوساميد بحذر مع المرضى الذين يخضعون للعلاج بمستحضرات طبية معروف ارتباطها بإطالة PR (مثل دواء كاربامازيبين ودواء لاموتريجين ودواء بريجابالين) ومع المرضى الذين يخضعون للعلاج بالأدوية المضادة لاضطراب النظم من الفئة الأولى. ومع ذلك، لم يحدد تحليل المجموعة الفرعية وجود زيادة كبيرة في إطالة PR لدى المرضى الذين تناولوا دواء كاربامازيبين أو دواء لاموتريجين بشكل متزامن في تجارب إكلينيكية. البيانات المعملية تشير البيانات عمومًا إلى أن لاكوساميد له إمكانيات تداخل منخفضة. تشير الدراسات المختبرية إلى أن الإنزيمات CYP1A2 ، و 2B6 ، و 2C9 لا يتم تحفيزها بلاكوساميد، وأن الإنزيمات CYP1A1 ، و 1A2 ، و 2A6 ، و 2B6 ، و 2C8 ، و 2C9 ، و 2D6 ، و 2E1 ، لا يتم تثبيطها بلاكوساميد في تركيزات البلازما التي تمت ملاحظتها في التجارب الإكلينيكية. تشير دراسة مختبرية إلى أن لاكوساميد لا يتم نقله بواسطة ب-جليكوبروتين في الأمعاء. توضح البيانات المعملية أن الإنزيمات CYP2C9 و CYP2C19 و CYP3A4 قادرة على تحفيز تكون مستقلب أو-ديسميثيل. بيانات الأحياء إن لاكوساميد لا يثبط ولا يحفز CYP2C19 و CYP3A4 إلى مدى ذي صلة إكلينيكية. لم يؤثر اللاكوساميد في المنطقة تحت المنحنى للميدازولام) يتم أيضه بواسطة ،CYP3A4 اللاكوساميد يُعطى 200 ملغ مرتين في اليوم) ولكن أقصى تركيز للميدازولام قد ازداد قليلاً (30 %). لم يؤثر لاكوساميد في الحرائك الدوائية للأوميبرازول (يتم أيضه بواسطة CYP2C19 و 3A4 ، ويُعطى اللاكوساميد بجرعة 300 ملغ مرتين يوميًا). الأوميبرازول المثبط لإنزيم CYP2C19 (بجرعة 40 ملغ مرة واحدة يوميًا ) لم يسبب ظهور تغير واضح إكلينيكيًا في التعرض للاكوساميد. ولهذا، فإن المثبطات المتوسطة لإنزيم CYP2C19 من غير المعتاد أن تؤثر في التعرض الجهازي للاكوساميد إلى مدى ذي صلة إكلينيكيًا. يوصى بتوخي الحذر عند العلاج المتزامن بمثبطات قوية لإنزيم CYP2C19 (مثل فلوكونازول) وإنزيم CYP3A4 (مثل إيتراكونازول و كيتوكونازول و ريتونافير و كلاريثرومايسين)، مما قد يؤدي إلى زيادة التعرض الجهازي للاكوساميد. لم يتم التحقق من هذه التفاعلات في الأحياء ولكنها محتملة استنادًا إلى البيانات المعملية. قد تقلل محفزات الإنزيمات القوية مثل دواء ريفامبيسين أو عشبة القديس جون (عشبة هيوفاريقون) التعرض الجهازي للاكوساميد بدرجة متوسطة. ومن ثم؛ ينبغي توخي الحذر عند بدء العلاج بمحفزات الإنزيمات أو إنهاء العلاج بها. مضادات الصرع في الدراسات التجريبية للتداخل الدوائي، فإن لاكوساميد لم يؤثر بشكل واضح في تركيزات الكاربامازيبين، وحمض الفالبرويك في البلازما. وتركيزات اللاكوساميد في البلازما لم تتأثر بتعاطي الكاربامازيبين، أو بتعاطي حمض الفالبرويك. ويشير تحليل لحركية الدواء لدى مجموعة من الأفراد إلى أن العلاج المتزامن بأدوية أخرى مضادة للصرع معروفة بأنها محفزة للإنزيم (كاربامازيبين، وفينيتوين، وفينوباربيتال، بجرعات مختلفة) قد قلل من التعرض الجهازي الكلي للاكوساميد بنسبة 25 %. موانع الحمل التي تعطى عن طريق الفم في دراسة تجريبية للتداخل الدوائي، لم يكن هناك أي تداخل ذي صلة إكلينيكيًا بين اللاكوساميد وأدوية منع الحمل التي تعطى عن طريق الفم، والتي تحتوي على الإيثينيل إستراديول، والليفونورجيستريل. ولم تتأثر تركيزات البروجيسترون عندما تم إعطاء أدوية أخرى بالتزامن معه. غير ذلك أظهرت الدراسات التجريبية للتداخل الدوائي أن اللاكوساميد ليس له أي تأثير في الحرائك الدوائية للديجوكسين. لم يكن هناك أي تداخل دوائي ذي صلة إكلينيكيًا بين اللاكوساميد والميتفورمين. لا يُؤدي تناول دواء وارفارين بالتزامن مع دواء لاكوساميد إلى تغيّ ذي صلة من الناحية الإكلينيكية في الحرائك الدوائية والديناميكية الدوائية لدواء وارفارين. على الرغم من عدم توفر بيانات الحرائك الدوائية بشأن تفاعل لاكوساميد مع المشروبات الكحولية، إلا أنه لا يمكن استبعاد تأثير الديناميكية الدوائية. ويتّسم اللاكوساميد بارتباط منخفض بالبروتين تقل نسبته عن 15 %. وبذلك؛ تصبح التفاعلات ذات الصلة من الناحية الإكلينيكية مع أدوية أخرى من خلال المنافسة لمواقع ارتباط البروتين غير محتملة.
4.6 الخصوبة والحمل والرضاعة الحمل: المخاطر المتعلقة بالصرع والأدوية المضادة للصرع بشكل عام. بالنسبة لكل الأدوية المضادة للصرع، فقد وُجد أنه لدى أبناء السيدات اللاتي تعالجن من الصرع، فإن نسبة حدوث التشوهات هي مرتان إلى ثلاث مرات أكبر من النسبة المعتادة بين عامة الناس، والتي تساوي تقريبًا 3% لدى الأفراد الذين يعالجون من الصرع، تمت ملاحظة وجود زيادة في التشوهات مع التعدد الدوائي، وعلى الرغم من ذلك، فإن مدى مسؤولية العلاج و/أو المرض عن حدوث ذلك لم يتم توضيحها. علاوة على ذلك، فإن العلاج المضاد للصرع الفعال لا يجب أن يتم قطعه؛ لأن تفاقم المرض يكون مضرًا للأم والجنين. المخاطر المتعلقة بلاكوساميد لا توجد بيانات كافية عن استخدام اللاكوساميد للسيدات الحوامل. الدراسات على الحيوانات لم ت شِ إلى أية تأثيرات ماسخة في الفئران أو الأرانب، ولكن تمت ملاحظة تسمم الأجنة في الفئران والأرانب بالجرعات السامة للأمهات (انظر القسم 5.3 ). الخطر المحتمل بالنسبة للبشر غير معروف. لا يجب استخدام لاكوساميد في أثناء الحمل ما لم يكن ذلك ضروريًا بشكل واضح (إذا كانت الفائدة التي تعود على الأم تفوق بشكل واضح الخطر المحتمل على الجنين). إذا قررت السيدة أن تكون حاملاً، فإن استخدام Vimpat يجب أن تتم إعادة تقييمه بحرص. الرضاعة الطبيعية من غير المعروف إذا كان اللاكوساميد يفرَز في لبن الأم في البشر أم لا. الدراسات على الحيوان قد أظهرت إفراز اللاكوساميد في لبن الأم. لاتخاذ التدابير الوقائية، ينبغي وقف الإرضاع خلال فترة العلاج بلاكوساميد. الخصوبة لم تتم ملاحظة آثار عكسية على خصوبة ذكور أو إناث الجرذان أو تناسلها عند إعطائهم جرعات تنتج تعرضًا للبلازما (المنطقة تحت المنحنى) يصل تقريبًا إلى ضعف المنطقة تحت المنحنى للبلازما في الإنسان عند أقصى جرعة يومية موصى بها للإنسان.
4.7 التأثيرات على إمكانية القيادة واستخدام الماكينات: لاكوساميد له تأثير ضئيل إلى متوسط في القدرة على القيادة واستخدام الآلات. العلاج بلاكوساميد قد تم ربطه بحدوث دوخة، أو عدم وضوح الرؤية. وفقًا لذلك، ينبغي نصح المرضى بعدم القيادة، أو تشغيل الآلات الخطرة الأخرى إلى أن يكونوا معتادين على تأثيرات لاكوساميد في قدرتهم على القيام بمثل هذه الأنشطة.
4.8 آثار غير مرغوبة: ملخص معلومات الأمان استنادًا إلى تحليل لمجموعة تجارب إكلينيكية مضبطة بالدواء الوهمي شارك فيها 1308 مريض مصاب ببداية النوبات الصرعية الجزئية، عانى عدد من المرضى بلغ إجمالي نسبتهم %61.9 ممن تم توزيعهم عشوائيًا على لاكوساميد ونسبة 35.2 % من المرضى الذين تم توزيعهم على العلاج الوهمي من تفاعل عكسي واحد على الأقل. وكانت أكثر التفاعلات العكسية شيوعًا التي تم الإبلاغ عنها الناجمة عن العلاج بلاكوساميد هي الدوخة والصداع والغثيان وازدواج الرؤية. وكانت التفاعلات العكسية خفيفة إلى متوسطة من حيث الشدة. وكان بعضها مرتبطًا بالجرعة، وقد يخف بتقليل الجرعة. وعادةً ما يقل حدوث التفاعلات العكسية وحدتها في الجهاز العصبي المركزي ( CNS ) والمعدة والأمعاء (GI) بمرور الوقت. وعبر كل الدراسات المُضبطة، كانت نسبة معدل إيقاف العلاج نتيجة التفاعلات العكسية %12.2 للمرضى الذين تم توزيعهم عشوائيًا على لاكوساميد و 1.6 % للمرضى الذين تم توزيعهم عشوائيًا على العلاج الوهمي. وكانت الدوخة هي التفاعل العكسي الأكثر شيوعًا الناتج عن إيقاف العلاج بلاكوساميد. قد يرتفع معدل حدوث التفاعلات العكسية في الجهاز العصبي المركزي مثل الدوخة بعد تناول جرعة تحميل. قائمة مجدولة للتفاعلات العكسية يوضِّح الجدول أدناه معدلات تكرار التفاعلات العكسية التي تم الإبلاغ عنها في التجارب الإكلينيكية وتجربة ما بعد التسويق. ويتم تحديد معدلات التكرار كما يلي: شائعة جدًا (≤ 1/10 )، شائعة (≤ 100 / 1 إلى > 10 / 1)، غير شائعة (≤ 1000 / 1 إلى > 100 / 1)، غير معروفة (لا يمكن تقدير معدل التكرار من البيانات المُتاحة). وضمن كل مجموعة من مجموعات التكرار، تم عرض الآثار غير المرغوبة بهدف تقليل المخاطر.
وصف التفاعلات العكسية المحددة
يقترن استعمال لاكوساميد بزيادة مرتبطة بالجرعة في فترة PR. وقد تحدث تفاعلات عكسية مقترنة بإطالة فترة PR (مثل الإحصار الأذيني البطيني والإغماء وبطء القلب).
وفي تجارب إكلينيكية أجريت على مرضى الصرع، كان معدل حدوث الإحصار الأذيني البطيني من الدرجة الأولى والذي تم الإبلاغ عنه غير شائع، حيث كان 0.7 % و 0% و 0.5 % و 0% للاكوساميد 200 ملغ أو 400 ملغ أو 600 ملغ أو الدواء الوهمي، على التوالي. ولم تتم ملاحظة إحصار أذيني بطيني من الدرجة الثانية أو أعلى في هذه الدراسات. ومع ذلك، تم الإبلاغ عن حالات إحصار أذيني بطيني من الدرجة الثانية والثالثة مرتبطة بالعلاج بلاكوساميد في تجربة ما بعد التسويق.
في تجارب إكلينيكية، كان معدل حدوث الإغماء غير شائع، ولم يختلف بين مرضى الصرع الذين خضعوا للعلاج بلاكوساميد ( 0.1 %) وبين مرضى الصرع الذين خضعوا للعلاج بالعلاج الوهمي ( 0.3 %).
ولم يتم الإبلاغ عن حدوث رجفان أذيني أو رفرفة أذينية في تجارب إكلينيكية قصيرة المدى؛ ولكن تم الإبلاغ عن حدوثهما في تجارب صرع معروفة الدواء وفي تجربة ما بعد التسويق.
الاضطرابات المعملية
تم ملاحظة اضطرابات في اختبارات وظائف الكبد في تجارب مُضبطة باستخدام لاكوساميد تم إجراؤها على مرضى بالغين يعانون من بداية النوبات الصرعية الجزئية ويتناولون دواءاً واحدًا متزامنًا إلى ثلاثة أدوية متزامنة من الأدوية المضادة للصرع. ولقد حدثت ارتفاعات في إنزيم ناقلَة أمينِ الألانين وصلت إلى ≤ 3 مرات أعلى من الحد الأعلى للنطاق الطبيعي في 0.7 % ) 935 / 7) من المرضى الذين تناولوا فيمبات و 0% ) 356 / 0) من المرضى الذين تناولوا الدواء الوهمي.
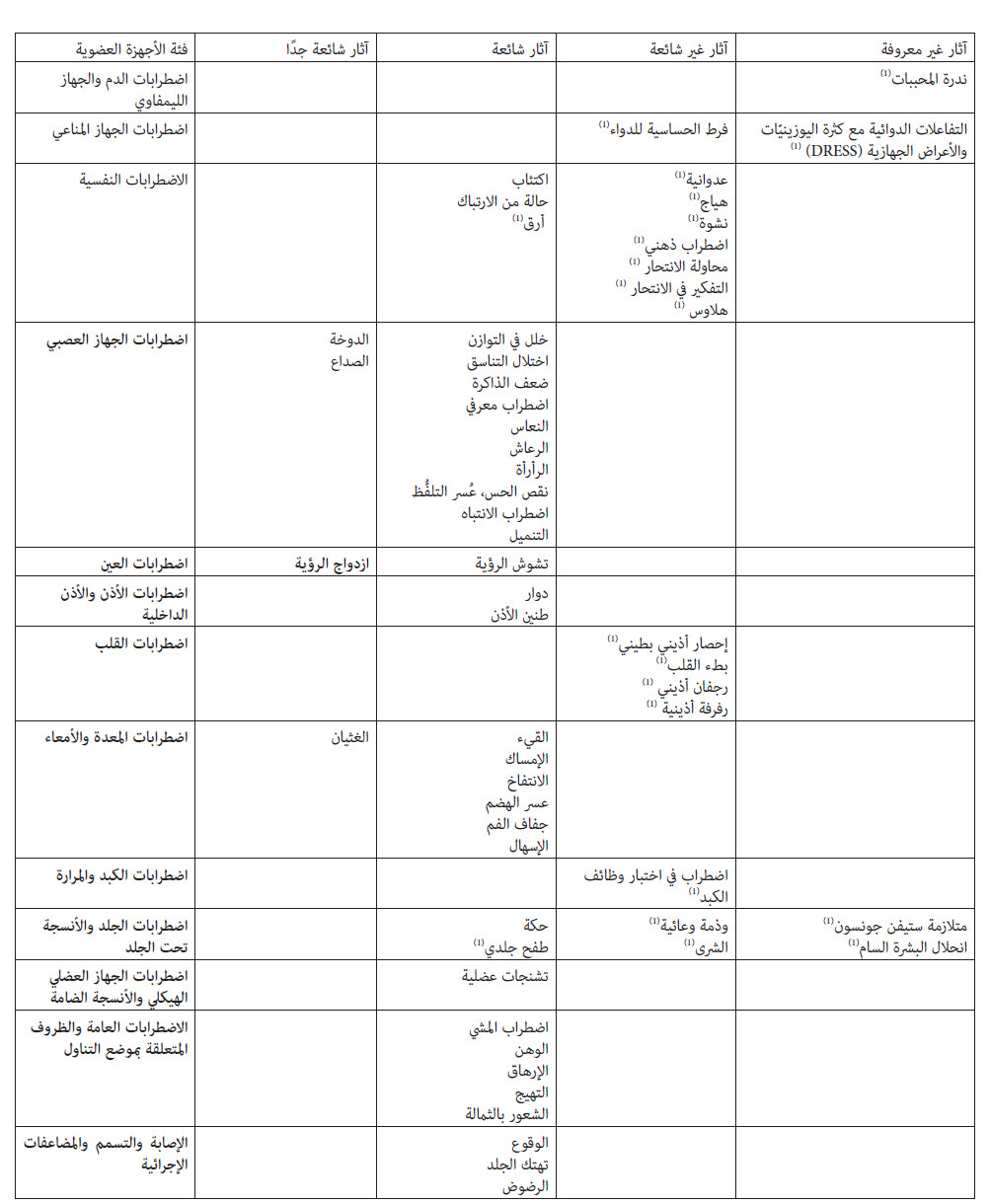
( 1) تفاعلات عكسية تم الإبلاغ عنها في تجربة ما بعد التسويق.
تفاعلات الحساسية المفرطة في العديد من الأعضاء
تم الإبلاغ عن تفاعلات الحساسية المفرطة في العديد من الأعضاء (والمعروفة أيضًا باسم التفاعلات الدوائية مع كثرة اليوزينيّات والأعراض الجهازية أو DRESS ) في المرضى الذين يخضعون للعلاج ببعض الأدوية المضادة للصرع. وهذه التفاعلات متغيرة في الشكل، ولكنها توجد مصحوبة عادةً بحمى وطفح جلدي، وقد تنطوي على أجهزة عضوية مختلفة. فإذا كان ثمة شك في تفاعلات الحساسية المفرطة في العديد من الأعضاء، فينبغي وقف لاكوساميد.
المرضى الأطفال
من المتوقّع تكرار حدوث التفاعلات المضادة ونوعها وحدّتها في المراهقين الذين تتراوح أعمارهم ما بين 16 – 18 عامًا لتصبح كما في البالغين. ولم يتحدد بعد أمان دواء لاكوساميد مع الأطفال البالغ أعمارهم أقل من 16 عامًا. ولا توجد بيانات متوفرة.
4.9 الجرعة المفرطة
توجد تجارب إكلينيكية محدودة بخصوص زيادة جرعة لاكوساميد في البشر.
الأعراض
كانت الأعراض الإكلينيكية (الدوخة والغثيان) التالية لتناول جرعات تبلغ 1200 ملغ/ يوم مرتبطة بشكل أساسي بالجهاز العصبي المركزي والجهاز المعدي المعوي، وزالت تلك الأعراض عند تعديل الجرعة.
كانت أعلى جرعة زائدة تم الإبلاغ عنها في برنامج التطوير الإكلينيكي للاكوساميد 12 جرامًا تم تناولها مع جرعات سمية من عدة أدوية أخرى مضادة للصرع. ولقد كان الشخص الخاضع للبرنامج مصابًا في البداية بغيبوبة ثم استفاق منها تمامًا بدون أن تكون هناك عواقب مَرَضية دائمة.
التدبير العلاجي
لا يوجد ترياق محدد للجرعة الزائدة من لاكوساميد. وينبغي أن يتضمن علاج الجرعة الزائدة من لاكوساميد إجراءات داعمة عامة، وقد يتضمن الخضوع لغسيل كلوي إذا لزم الأمر (انظر القسم 5.2 ).
5. الخصائص الدوائية
5.1 الخصائص الديناميكية الدوائية
المجموعة العلاجية الدوائية: الادوية المضادة للصرع، أدوية أخرى مضادة للصرع، رمز التصنيف الكيميائي العلاجي التشريحي: N03AX18.
آلية عمل دواء Vimpat
المادة الفعالة، لاكوساميد (آر- 2-أستميدو-إن-بنزيل- 3-ميثوكسيبروبيوناميد) عبارة عن حمض أميني وظيفي.
تظل الآلية الدقيقة التي يفرز بها لاكوساميد تأثيره المضاد للصرع في البشر واضحة تمامًا.
أوضحت الكهربية الفسيولوجية المعملية أن لاكوساميد يعزز بشكل انتقائي التعطيل البطيء لقنوات الصوديوم ذات البوابات الفولطية، مما يؤدي إلى استقرار الأغشية العصبية الشديدة الاستثارة.
التأثيرات الديناميكية الدوائية
وقى لاكوساميد مجموعة كبيرة من عينات الحيوانات من نوبات الصرع المعممة الأساسية والجزئية، وأدى إلى تأجيل تطور الإثارة.
وفي تجارب غير إكلينيكية، أظهر لاكوساميد بالاشتراك مع دواء ليفيتيراسيتام أو دواء كاربامازيبين أو دواء فينيتوين أو دواء فالبورويت أو دواء لاموتريجين أو دواء توبيرامات أو دواء جابابينتين تأثيرات إضافية أو تآزرية مضادة للتشنج.
الأمان والفعالية السريرية
تم التحقق من فعالية فيمبات Vimpat كعلاج مساعد عند اتباع الجرعات الموصى بها ( 200 ملغ/ يوم، 400 ملغ/يوم) في 3 تجارب إكلينيكية عشوائية متعددة المراكز ومضبطة بالدواء الوهمي استمرت فيها فترة المداومة 12 أسبوعًا. كما اتضح أن فيبمات بجرعة 600 ملغ/ يوم كان فعالاً في تجارب العلاج المساعد المُضبطة، بالرغم من أن الفعالية كانت مشابهة لفعالية الجرعة البالغة 400 ملغ/يوم وكان احتمال تحمل المرضى لهذه الجرعة قليلاً بسبب التفاعلات العكسية المرتبطة بالمعدة والأمعاء والجهاز العصبي المركزي. لذا لا يوصى بجرعة 600 ملغ/يوم. تبلغ أقصى جرعة موصى بها 400 ملغ/يوم. تم تصميم هذه التجارب، التي شارك فيها 1308 مريض لديهم تاريخ مرضي من الإصابة ببداية النوبات الصرعية الجزئية عند 23 عامًا في المتوسط، لتقييم فعالية وأمان لاكوساميد عندما يتناوله مرضى يعانون من بداية النوبات الصرعية الجزئية التي لا يتم التحكم فيها والمصحوبة بتعميم ثانوي أو غير المصحوبة به بالتزامن مع 1- 3 أدوية مضادة للصرع. وبوجه عام، كانت نسبة المشاركين في التجارب الذين انخفض تكرار نوبات الصرع لديهم بنسبة 50 % هي 23 % و 34 % و 40 % للعلاج الوهمي ولاكوساميد 200 ملغ/يوم ولاكوساميد 400 ملغ/يوم.
ولا توجد بيانات كافية فيما يتعلق بالانسحاب بشأن المستحضرات الدوائية المضادة للصرع المتزامنة بغرض العلاج بلاكوساميد بمفرده.
وتم تحديد الحرائك الدوائية والأمان لجرعة تحميل مفردة من لاكوساميد تؤخذ عن طريق التسريب الوريدي في دراسة متعددة المراكز ومعروفة الدواء لتقييم أمان وتحمل البدء السريع للاكوساميد باستخدام جرعة تحميل مفردة تؤخذ عن طريق التسريب الوريدي (تحتوي على 200 ملغ) متبوعة بجرعات تؤخذ عن طريق الفم مرتين يوميًا (تعادل الجرعة عن طريق الوريد) كعلاج مساعد لدى الأشخاص المشاركين البالغين الذين تتراوح أعمارهم ما بين 16 إلى 60 عامًا والمصابين ببداية النوبات الصرعية الجزئية.
5.2 خصائص الحرائك الدوائية
الامتصاص
يُتص لاكوساميد امتصاصًا سريعًا وكاملاً عن طريق الفم. وتصل نسبة التوافر البيولوجي لأقراص لاكوساميد عن طريق الفم إلى 100 %. وعقب تناوله عن طريق الفم، يرتفع تركيز البلازما لدواء لاكوساميد غير المتغيِّ ارتفاعًا سريعًا، ويصل أقصى تركيز للدواء إلى ما يقرب من 0.5 إلى 4 ساعات بعد الجرعة. وتتسم كل من أقراص Vimpat والشراب الذي يتم تناوله عن طريق الفم بالتكافؤ البيولوجي. ولا يؤثر الطعام على معدل الامتصاص أو مداه.
التوزيع
يبلغ حجم التوزيع 0.6 لتر/كجم تقريبًا. ويرتبط لاكوساميد بنسبة تقل عن 15 % ببروتينات البلازما.
التحول البيولوجي
يتم إفراز 95 % من الجرعة في البول على هيئة دواء ومستقلبات. ولم يتم تمييز استقلاب لاكوساميد بشكل كامل.
المكونات الرئيسية التي يتم إفرازها في البول هي لاكوساميد بدون تغيير (حوالي 40 % من الجرعة) ومستقلب أو-ديسميثيل الخاص به الذي تبلغ نسبته أقل من 30 %.
ويُقترح أن يكون جزء قطبي من المشتقات السيرينية هو المسئول عن 20 % تقريبًا في البول، ولكن تم اكتشافه بكميات قليلة فقط ) 0- 2%) في بلازما بعض المشاركين. ووجدت كميات قليلة ( 0.5 – 2%) من مستقلبات إضافية في البول.
وتوضح الدراسات المعملية أن الإنزيمات CYP2C9 و CYP2C19 و CYP3A4 قادرة على تحفيز تكون مستقلب مركب أو-ديسميثيل ولكن لم يتم التأكد من النظير الإنزيمي المشارك الأساسي في الأحياء. لم تتم ملاحظة اختلاف ذي صلة إكلينيكية في التعرض للاكوساميد عند مقارنة حرائكه الدوائية في مستقلبات شاملة (مستقلبات شاملة، مع إنزيم CYP2C19 وظيفي) ومستقلبات ضعيفة (مستقلبات ضعيفة، تفتقر إلى إنزيم CYP2C19 وظيفي). علاوة على ذلك، لم تظهر تجربة تفاعل مع دواء أوميبرازول (مثبط إنزيم- CYP2C19 ) تغييرات ذات صلة إكلينيكية في تركيزات لاكوساميد في البلازما مما يشير إلى أن أهمية هذا المسار ضئيلة. بلغت تركيزات البلازما الخاصة بمركب أوديسميثيل-لاكوساميد 15 % تقريبًا من تركيز لاكوساميد في البلازما. وليس لهذا المستقلب الرئيسي نشاط دوائي معروف.
الإزالة
تتم إزالة لاكوساميد بشكل أساسي من الدورة الدموية الكبرى بواسطة الإفراز الكلوي والتحول البيولوجي. بعد تناول لاكوساميد المعلم إشعاعيًا عن طريق الفم وعن طريق الوريد، تم إفراز 95 % تقريبًا من النشاط الإشعاعي الذي تم إعطاؤه في البول وأقل من %0.5 في البراز. وتبلغ فترة نصف عمر الإزالة للدواء غير المتغير 13 ساعة تقريبًا.
وتتناسب الحرائك الدوائية مع الجرعة وتثبت مع مرور الوقت، مع معدل تغير داخلي وبيني منخفض للمريض. بعد تناول الجرعات مرتين يوميًا، يتم الوصول إلى تركيزات البلازما عند حالة الثبات بعد فترة تبلغ 3 أيام. ويزيد تركيز البلازما بمعامل تراكم يبلغ 2 تقريبًا.
وتقترب جرعة تحميل مفردة بمقدار 200 ملغ من تركيزات الحالة الثابتة المشابهة لتناول 100 ملغ مرتين يوميًا عن طريق الفم.
الحرائك الدوائية في فئات خاصة من المرضى
الجنس: تشير التجارب الإكلينيكية إلى أن الجنس ليس له تأثير مهم إكلينيكيًا على تركيزات لاكوساميد في البلازما.
القصور الكلوي
زادت المنطقة تحت المنحنى الخاصة بلاكوساميد بنسبة تقترب من 30 % في المرضى المصابين بقصور كلوي خفيف ومتوسط وبنسبة 60 % في المرضى المصابين بقصور كلوي شديد والمرضى المصابين بمرض كلوي في مراحله المتأخرة ممن يحتاجون إلى غسيل كلوي مقارنة بالأشخاص الأصحاء، بينما لم يتأثر أقصى تركيز للدواء في مصل الدم.
وتتم إزالة لاكوساميد من البلازما بشكل فعال بواسطة الغسيل الكلوي. بعد العلاج بالغسيل الكلوي لمدة 4 ساعات، تقل المنطقة تحت المنحنى الخاصة بلاكوساميد بنسبة %50 تقريبًا. ولذا يوصى بمكملات للجرعات بعد الغسيل الكلوي (انظر القسم 4.2 ).
ولقد زاد التعرض الخاص بمستقلب أو-ديسميثيل بعدة أضعاف في المرضى المصابين بقصور كلوي متوسط وشديد. وعندما لم يخضع المرضى المصابون بمرض كلوي في مراحله المتأخرة لغسيل كلوي، زادت المستويات واستمرت في الازدياد خلال إجراء أخذ العينات الذي استمر 24 ساعة. من غير المعروف ما إذا كانت زيادة تعرض المستقلب لدى الأشخاص المصابين بمرض كلوي في مراحله المتأخرة تزيد من الآثار العكسية أم لا، ولكن لم يتم تحديد النشاط الدوائي الخاص بالمستقلب.
القصور الكبدي
اتضح أن تركيزات لاكوساميد في بلازما الأشخاص المصابين بقصور كبدي متوسط (فئة B على مقياس Child-Pugh ) أعلى (بنسبة 50 % تقريبًا من المنطقة تحت المنحنى العادية). كانت زيادة التعرض ناتجة بشكل جزئي عن انخفاض وظيفة الكلى في الأشخاص الذين أجريت عليهم الدراسة. ووفق التقديرات، أدى الانخفاض في التصفية غير الكلوية لدى المرضى المشاركين في الدراسة إلى زيادة تبلغ نسبتها 20 % في المنطقة تحت المنحنى الخاصة بلاكوساميد. لم يتم تقييم الحرائك الدوائية للاكوساميد لدى المرضى المصابين بقصور كبدي شديد (انظر القسم 4.2 ).
كبار السن (الذين تزيد أعمارهم على 65 عامًا)
في دراسة تم إجراؤها على رجال وسيدات كبار السن من بينهم 4 مرضى تزيد أعمارهم على 75 سنة، زادت المنطقة تحت المنحنى تقريبًا بنسبة 30 % و 50 % مقارنة بالأشخاص الصغار السن، على التوالي. وهو ما ارتبط بصورة جزئية بانخفاض وزن الجسم. وكان الفرق المعدل لوزن الجسم 26 % و 23 %، على التوالي. كما لوحظ أيضًا ارتفاع التغيّ في التعرض. ولم تكن التصفية الكلوية للاكوساميد منخفضة إلى حد ما إلا لدى الأشخاص الكبار السن المشاركين في هذه الدراسة.
ولا يُعدّ خفض الجرعة بشكل عام ضروريًا ما لم يوصَ بذلك بسبب انخفاض وظائف الكلى (انظر القسم 4.2 ).
5.3 بيانات الأمان الوقائية
في دراسات السمية، كانت تركيزات لاكوساميد في البلازما التي تم الحصول عليها مشابهة لتلك التركيزات التي تمت ملاحظتها في المرضى أو أعلى منها بشكل طفيف، مما نتج عنه هوامش قليلة أو غير موجودة في التعرض البشري.
أظهرت دراسة للسلامة الدوائية تم فيها إعطاء كلاب مخدرة لاكوساميد عن طريق التسريب الوريدي زيادات عابرة في فترة PR ومدة مركب QRS وانخفاضات في ضغط الدم كانت على الأرجح بسبب مفعول مخمد قَلبي. وبدأت هذه التغييرات العابرة في نفس نطاق التركيز الذي تم الوصول إليه بعد تناول أقصى جرعات إكلينيكية موصى بها.
عند إعطاء جرعات تراوحت من 15 إلى 60 ملغ/كجم عن طريق التسريب الوريدي إلى قرود الرماح والكلاب المخدرة وإبطاء الموصلية البطينية والأذينية، لوحظ حدوث إحصار أذيني بطيني وتفارق أذيني بطيني.
وفى دراسات السمية الناتجة عن الجرعات المتكررة، لوحظت تغييرات كبدية خفيفة وقابلة للشفاء في الجرذان تبدأ عند 3 مرات تقريبًا من التعرض الإكلينيكي. وتضمنت هذه التغييرات زيادة في وزن الأعضاء وتضخم الخلايا الكبدية وزيادات في تركيزات الإنزيمات الكبدية في مصل الدم وزيادات في إجمالي الكوليستيرول وثلاثي الجليسريد.
وباستثناء تضخم الخلايا الكبدية، لم تلاحظ تغييرات مرضية أخرى بالأنسجة.
وفي دراسات سمية خاصة بالنمو والتناسل في القوارض والأرانب، لم يلاحظ حدوث آثار مشوهة للأجنة، ولكن لوحظت زيادة في أعداد المواليد المُجهضة وحالات موت المواليد في الفترة المحيطة بالولادة، وانخفاض عدد المواليد الأحياء إلى حد ما بالإضافة إلى انخفاض وزن جسم المواليد عند إعطاء الجرذان الأمهات جرعات سامة تعادل مستويات التعرض الجهازي المماثلة للتعرض الإكلينيكي المتوقع. ونظرًا لأن مستويات التعرض الأعلى لم يتم اختبارها في الحيوانات نتيجة لتسمم الأمهات، تعد البيانات غير كافية لتمييز احتمالية حدوث تشوهات بالأجنة وتسممها نتيجة لتناول لاكوساميد تمييزًا كاملاً.
أوضحت الدراسات التي أجريت على الجرذان أن لاكوساميد و/أو مستقلباته قد عبرت حاجز المشيمة بسرعة.
6. التفاصيل الدوائية
6.1 قائمة مواد السواغ
المكونات الأساسية لأقراص Vimpat:
ميكروكريستالين سيليلوز.
هيدروكسي بروبيل السيللوز.
هيدروكسي بروبيل السيللوز (منخفض الإحلال).
سيليكا غروانية لامائية.
كروسبوفيدون (بولي بلازدون إكس إل- 10 موافق للتصنيفات الدوائية) ستيرات المغنيسيوم.
غلاف القرص
كحول عديد الفاينيل.
بولي إيثيلين جلايكول 3350.
تالك.
ثاني أكسيد التيتانيوم (E171)
أقراص 50 ملغ: أكسيد حديد أحمر ( E172 )، أكسيد حديد أسود ( E172 )، صبغة ألومينيوم بلون قرمزي نيلي (E132).
أقراص 100 ملغ: أكسيد حديد أصفر (E172).
أقراص 150 ملغ: أكسيد حديد أصفر ( E172 ), أكسيد حديد أحمر ( E172 ), أكسيد حديد أسود (E172).
أقراص 200 ملغ: صبغة ألومينيوم بلون قرمزي نيلي (E132).
6.2 المواد المتعارضة: لا تنطبق.
6.3 احتياطات خاصة بتخزين Vimpat
يُخزَّن في درجة حرارة لا تزيد عن 30 درجة مئوية.
يُحفظ Vimpat بعيدًا عن متناول ومرأى الأطفال.
لا يُستخدَم بعد تاريخ انتهاء الصلاحية المذكور على العلبة والشريط.
6.4 طبيعة عبوة دواء Vimpat ومحتوياتها
عبوات تحتوي على 14 و 56 من الأقراص المغلفة.
شريط من البولي فينيل كلورايد/البولي فينيليدين كلورايد مغطى برقائق الألومنيوم.
قد لا يتم تسويق كل التركيزات و/أو أحجام العبوات.
6.5 احتياطات خاصة للتخلص
لا توجد متطلبات خاصة للتخلص.
الشركة المصنّعة لدواء Vimpat وحامل الترخيص
الشركة المصنّعة:
Aesica Pharmaceuticals GmbH Galileistraße 6 08056 Zwickau Germany Batch released by Aesica Pharmaceuticals GmbH Alfred Nobel Strasse 10 40789 Monheim Am Rhein Germany
حامل الترخيص: UCB Pharma SA Allee de la Recherche 60 B-1070 Bruxelles Belgium